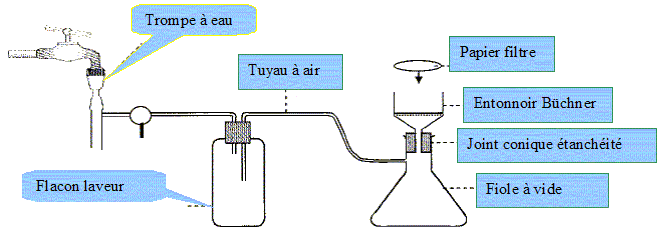
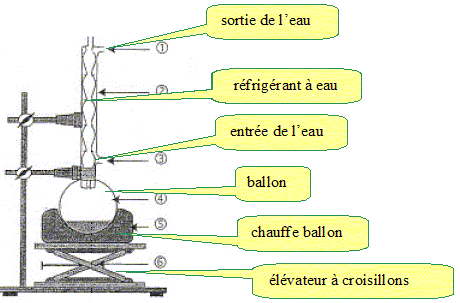
MOTIVATION (8 PTS)
1.1 Le poste pour lequel vous postulez (4 pts)
Décrivez en une dizaine de lignes les activités que vous serez amené(e)
à exercer en tant que technicien/ne en chimie et sciences physiques.
Conduire des expériences de laboratoire, réaliser des préparations, des
analyses ou des synthèses courantes suivant un protocole bien défini.
Développer de nouvelles techniques d'analyse ou de synthèse.
Effectuer le réglage des appareils, l'étalonnage et la maintenance de premier niveau.
Tenir un cahier de laboratoire ; élaborer des fiches de préparations des réactifs et solutions.
Appliquer et faire appliquer les règles d'hygiène et de sécurité.
Effectuer les approvisionnements et la gestion des stocks.
1.2 Vos atouts pour l’emploi auquel vous postulez (4 pts) :
En quoi votre formation et votre expérience vous ont elles préparé(e) à
occuper ce poste de technicien(ne) en chimie et sciences physiques?
Etre à l'écoute, faiire preuve de curiosité, de réactivité, organiser
son travail en fonction des priorités et des objectifs ; travailler en
équipe ; faire preuve d'autonomie.
2. CONNAISSANCES GENERALES (12 PTS)
2.1 Connaissance du monde de l’enseignement supérieur (3 pts)
2.1.1 Expliciter les acronymes suivants : 1,5 pt
ITRF : ingénieur et personnel technique de recherche et de formation.
CNRS : centre national de recherche scientifique.
BAP : branche d'activité proessionnelle.
UMR : unité mixte de recherche.
SST : sauveteur secouriste du travail.
RGPD : règlement général sur la protection des données.
2.1.2 Répondre aux questions suivantes : 1,5 pts
2.1.2.1 Citer 2 corps de personnels techniques à l’université (0,5 pt)
ITRF de catégorie A, ingénieur.
ITRF de catégorie B, technicien.
2.1.2.2 Quel est le corps normalement accessible depuis le niveau Technicien dans le cadre d’une promotion par concours ?
Corps de catégorie A.
2.1.2.3 Citez trois organismes de recherche français (Développer le sigle) (0,5 pt)
CNRS centre national de recherche scientifique.
Inrae : institut national de la recherche agronomique et de l'environnement.
CEA : commissariat à l'énergie atomique.
2.2 Grandeurs fondamentales (3 pts)
Compléter le tableau suivant :
Grandeur
|
Symbole
|
nom de l'unité SI
|
Symbole SI
|
Exemple d'instrument
ou méthode de mesure associée
|
longueur
|
L
|
mètre
|
m
|
mètre
|
Masse
|
m
|
kilogramme
|
kg
|
balance
|
Temps
|
T
|
seconde
|
s
|
chronomètre
|
Intensité du courant électrique
|
I
|
ampère
|
A
|
ampèremètre
|
Quantité de matière
|
N
|
mole
|
mol
|
masse / masse molaire
|
température
|
q
|
kelvin
|
K
|
thermomètre
|
2.3 Quelques définitions (2 pts)
2.3.1 Qu’est-ce que le pH d’une solution : (1 pt)
Potentiel hydrogène : il représente une mesure de l'acidité ou de l'alcalinité en chimie d'une solution ou d'un milieu.
2.3.2 Classification périodique (1 pt)
Que signifient : Be ; 4 ; 9,0121831 ?
Elément bérilium ; 4ème position dans la classification périodique ou numéro atomique ;
masse molaire atomique :
9,0121831 g/mol.
2.4 Multiples et conversions d’unités (4 pts).
2.4.1 Préfixes multiplicateurs ou diviseurs des unités. Compléter le tableau suivant : (2 pts).
Nom
|
méga
|
nano
|
micro
|
giga
|
milli
|
pico
|
puissance de 10
|
106
|
10-9
|
10-6
|
109
|
10-3
|
10-12
|
symbole
|
M
|
n
|
µ
|
G
|
m
|
p
|
2.4.2 Convertir les données suivantes dans l’unité demandée en exprimant le résultat en notation scientifique : (2 pts)
50 µL = 50 10
-6 L = 50 10
-9 m
3 = 5 10
-8 m
3.
2000 cm
-1= 2000 / cm = 2000 / (0,01 m) =2 10
5 m
-1.
77 K = (77 -273) °C = -196 °C = -1,96 10
2 °C.
5 MHz = 5 10
6 Hz = 5 10
6 s
-1.
3 . CHIMIE GENERALE (8 PTS)
3.1 Préparation d’une solution (7 pts)
3.1.1 Vous devez préparer une solution molaire de chlorure de sodium (masse molaire : 58 g.mol
-1) puis faire une dilution pour obtenir 100 mL de solution 0,1 M. (3 pts)
Détaillez directement sur la copie les calculs, les différentes étapes et le matériel que vous pensez utiliser.
Peser 58g de solide et dissoudre dans une fiole jaugée de 1 L contenant 1 /3 d'eau distillée.
Compléter jusqu'au trait de jauge avec de l'eau distillée. Agiter pour rendre homogène.
Prélever 10,0 mL de solution mère à la pipette jaugée. Placer dans une
fiole jaugée de 100 mL contenant 1 /3 d'eau distillée . Agiter.
Compléter jusqu'au trait de jauge avec de l'eau distillée. Agiter pour rendre homogène.
3.1.2 Vous devez préparer une solution d’acide chlorhydrique à une concentration de 1 mol.L-1
à partir d’une bouteille de 2,5 L d’acide chlorhydrique commercial à
37% dont les caractéristiques sont données cidessous : (4 pts)
Formule : HCl Masse molaire : 36,5 g. mol.L-1
Densité : 1,19 Point d’ébullition : 48°C à 1013 hPa
3.1.2.1 Quelle est la concentration molaire de l’acide chlorhydrique commercial ? (2 pts)
Maase de 1 L : 1,19 kg. Masse d'acide chlorhydrique : 1,19 x0,37 =0,44 kg.
Concentration : 440 / 36,5 ~ 12 mol / L.
3.1.2.2 Quel volume d’acide chlorhydrique commercial devez-vous prélever pour réaliser 1L d’acide chlorhydrique à environ 1 mol.L-1 ? (2 pts).
Facteur de dilution : 12 ; volume à prélever : 1000 /12~83 mL.
3.2 pH des solutions (1 pt)
Quatre solutions différentes A, B, C, D se trouvent conservées dans
quatre flacons numérotés 1, 2, 3, 4 dont les étiquettes ne sont plus
lisibles.
On sait que :
A : solution de chlorure d’hydrogène est à 0,01 mol.L-1
B : solution d’hydroxyde de sodium est à 0,01 mol.L-1
C : solution d’ammoniac est à 0,02 mol.L-1
D : solution de chlorure de sodium est à 0,01 mol.L-1
Le pH de chaque solution est mesuré à 25°C
Complétez le tableau suivant :
numéro du flacon
|
1
|
2
|
3
|
4
|
pH mesuré
|
12
|
10,6
|
2
|
7
|
Solution
|
B
|
C
|
A
|
D
|
4. CHIMIE ORGANIQUE – SYNTHESE (9 PTS)
4.1 Maitrise des formules chimiques (4 pts)
4.1.1 L’articaïne, anesthésique local utilisé en odontologie, est représentée cidessous : (1 pt)
Donnez le nom des fonctions chimiques.
 4.1.2
4.1.2 Formule semi-développée, formule brute et familles de composés (3 pts)
 4.2
4.2 Solvants courants (2 pts)
Reliez directement sur la copie les noms des solvants avec leurs formules.
 4.3 Exemple de réaction : l’estérification
4.3 Exemple de réaction : l’estérification (2 pts)
Donnez la formule générale de cette réaction. (1 pt)
R-COOH + R'-OH = RCOOR' +H
2O.
Ecrire l’équation de la réaction qui se produit lorsqu’on réalise les mélange indiqué ci-dessous.
L’équation sera écrite à l’aide de formules semi-développées.
 4.4
4.4 Caractérisation des produits formés (1 pt)
Citer au moins une méthode de caractérisation du composé obtenu.
Spectre IR, RMN du proton.
5. SPECTROSCOPIES (9 PTS)
5.1 Spectroscopie UV-Visible) (4 pts)
Rappelez le principe de la spectroscopie UV-Visible et la loi de Lambert-Beer. Nommez les variables et les unités associées.
La spectroscopie d'absorption dans l'ultra-violet et le visible repose
sur l'absorption du rayonnement par les molécules dans le domaine 190 à
800 nm.
A= log (I0/I) = elc ( A est l'absorbance ou densité optique)
Cette loi est vérifiée lorsque la solution est de concentration inférieure à : c < 0,1 mol.L-1.
e (L mol-1 cm-1) est une caractéristique de la molécule. Plus e sera grand, plus la solution absorbe.
l est l'épaisseur de la cuve (cm) et c la concentration de la solution (mol/L).
5.2 Spectroscopie RMN (2,5 pts)
Rappelez le principe de la spectroscopie RMN.
La
spectroscopie par résonance magnétique nucléaire ou RMN consiste à
soumettre une espèce chimique à une onde électromagnétique
radiofréquence et à l'action d'un champ magnétique constant. A une
fréquence particulière appelée fréquence de résonance, certains noyaux
de l'espèce chimique vont être le siège d'une transition énergétique.
Les effets de cette transition sont détectés par une sonde.
La
valeur de cette fréquence de résonance dépend de la nature du noyau et
de son environnement. La spectroscopie utilisée ici est uniquement
celle du noyau d'hydrogène 11H souvent appelée RMN du proton. L'échantillon analysé est dissous dans un solvant deutéré de formule brute CDCl3 ou le noyau d'hydrogène 11H a été remplacé par un noyau de deutérium D.
5.3 Spectroscopie IR (2,5 pts)
Rappelez le principe de la spectroscopie Infra-Rouge.
La
spectrométrie infrarouge s’utilise principalement pour l’analyse
qualitative d’une molécule. Elle permet de mettre en évidence la
présence d’une liaison particulière. Dans une molécule, les liaisons
chimiques peuvent être décrites comme des ressorts liant les atomes.
Lorsqu’une molécule absorbe de l’énergie sous la forme d’un rayonnement
infrarouge, les atomes se mettent à vibrer. Ils entrent alors en
oscillation.