Synthèse du paracétamol (40 points).
Dans
un ballon de 100 mL, on introduit 5,4 g de para-aminophénol, 50 mL
d'eau et 3,5 mL d'acide éthanoïque. On adapte un réfrigérant puis on
chauffe au bain-marie à 80°C en agitant pour obtenir une dissolution
complète. On ramène la solution à température ambiante en refroidissant
le ballon dans un bain d'eau froide. On ajoute alors en trois ou quatre
fois, 7,0 mL d'anhydride éthanoïque, tout en agitant. Le mélange
s'échauffe légèrement. Une fois l'addition terminée, on le chauffe à
80°C, à l'aide d'un bain-marie, durant 10 minutes. Le mélange
réactionnel est ensuite refroidi dans un bain d'eau glacée jusqu'à ce
que le produit cristallise. Il est alors isolé par filtration. Ce
paracétamol "brut" est alors purifié par recristallisation dans l'eau.
a) Pour les molécules de para-aminophénol et paracétamol, indiquer les fonctions chimiques et les nommer.

b) Combien d'atomes de carbone hybridés sp3 la molécule de paracétamol possède-t-elle ? Justifier.
Un seul atome de carbone. H3C en position alpha de C=O.
c) Donner la formule brute du paracétamol et calculer sa masse molaire.
C8H9NO2 ; M =151 g / mol.
d) Donner le nom
usuel de l'acide éthanoïque. Pourquoi emploie-t-on souvent le terme
acide éthanoïque "glacial" pour préciser qu'il s'agit d'un acide
carboxylique pur et non en solution dans l'eau ?
Acide acétique.
L'acide acétique glacial renferme plus de 99 % d'acide.
On le surnomme glacial car il cristallise dès que la température descend en dessous de 16,7°C qui est sa température de fusion.
e) Pourquoi l'acide éthanoïque présente-t-il une très grande solubilité dans l'eau ? Justifier.
L'eau est un solvant polaire. La présence du groupe COOH fait que la
molécule d'acide acétique est polaire, donc soluble dans un solvant
polaire.
f) L'acide éthanoïque est-il un acide fort ou faible ? Justifier.
Le pKa du couple acide éthanoïque / ion éthanoate est voisin de 4,8. C'est donc un acide faible.
g) Calculer le pH d'une solution aqueuse d'acide éthanoïque à la concentration de 1,0 mol.L-1.
pH = ½pKa -½log C =0,5 x4,8 -0,5 log (1) = 2,4.
h) En plus de
l'anhydride éthanoïque, citez un autre dérivé d'acide carboxylique qui
permet, du moins en théorie, de réaliser cette synthèse du paracétamol.
Dessiner et nommer cette molécule.
Le chlorure d'éthanoyle.
i) Donner les
inconvénients majeurs de ce dérivé d'acide par rapport à l'anhydride
utilisé dans le protocole expérimental de cet exercice.
Réaction parasite avec l'eau donnant l'acide carboxylique.
Ils sont lacrymogènes, réagissant à la surface de l'oeil avec l'eau en produisant de l'acide chlorhydrique.
Les réactions sont vives et il faut piéger HCl formé.
j) Identifier,
en justifiant votre réponse, les deux sites donneurs de doublets
d'électrons présents sur la molécule de para-aminophénol.
L'atome d'oxygène porte deux doublets non liants et l'atome d'azote porte un doublet non liant.
k) Lors de la
réaction entre le para-aminophénol et l'anhydride éthanoïque, est-il
possible d'obtenir un autre produit que le paracétamol ? Justifier
votre réponse en dessinant un mécanisme simplifié de la réaction et en
vous appuyant sur votre réponse à la question précédente.

l) Expliquer la solubilité médiocre du para-aminophénol dans l'eau à 20°C (8,0 g.L
-1).
Présence du cycle benzénique.
m) La solubilité du
para-aminophenol dans une solution aqueuse 0,05 M de carbonate de
sodium (pH=11,5) est-elle inférieure ou supérieure à 8,0 g.L
-1 ? Justifier.
Du fait de la présence des groupes amine et hydroxyle, la paraminophénol est soluble dans les acides et les bases :
la solubilité est supérieure à 8,0 g / L.
n) Quel est le rôle
de l'acide éthanoïque dans la première étape de la réaction ? Pourquoi
observe-t-on une solubilisation du milieu réactionnel ? Justifier en
écrivant la réaction mise en jeu.
L'acide éthanoïque joue le rôle de solvant.
R-COOH + R'-NH
2 = RCOO
- + R'-NH
3+.
o) Calculer la concentration (en mol.L
-1)
en acide éthanoïque de la solution obtenue par dissolution de 3,5 mL de
cet acide carboxylique dans 50,0 mL d'eau. Détailler le calcul.
Densité de l'acide étha
noïque d = 1,05 ; M = 60 g / mol.
Masse d'acide dans 3,5 mL : 3,5 x1,05 =3,675 g
Quantité de matière n = 3,675 / 60 =0,06125 mol dans 50 mL.
C = 0,06125 / 0,050 ~ 1,2 mol/ L.
p) Quel est le réactif limitant de cette réaction de synthèse du paracétamol ? Justifier par le calcul.
5,4 g de para-aminophénol soit 5,4 / 109 ~0,050 mol.
3,5 mL d'acide éthanoïque soit 0,061 mol.
Les coefficients stoéchiométriques étant identiques, l'acide éthanoïque est en excès.
q) Définir ce qu'on entend par "chauffage à reflux". Est-ce le cas dans ce protocole de synthèse du paracétamol ?
Le chauffage à reflux permet d'accélérer la réaction ( la température est un facteur cinétique) sans pertes de matière.
Dans le protocole, il s'agit de chauffer la solution afin que le solide
se dissolve rapidement dans le solvant eau acide éthanoïque.
r) Quelle pièce de verrerie faut-il utiliser pour ajouter la quantité d'anhydride éthanoïque mise en jeu dans la réaction ?
Ampoule de coullée.
s) Définir ce qu'on entend par réaction exothermique. Est-ce le cas avec la synthèse du paracétamol ?
Une réaction exothermique s'accompagne d'un dégagement de chaleur dans
le milieu extérieur. Ce n'est pas le cas dans cette synthèse.
t) Schématiser le
montage expérimental utilisé pour isoler par filtration le paracétamol
"brut" et nommer la verrerie et matériel utilisés.
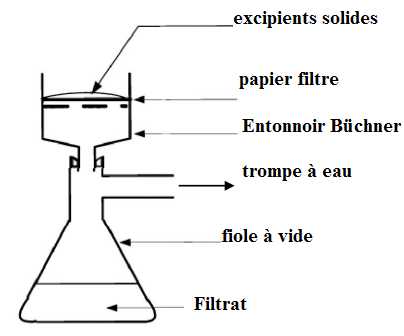
u) Expliquer en détail le principe d'une purification par recristallisation.
Séparer le paracétamol des impuretés
en jouant sur la différence de solubilité du paracétamol et des
impuretés dan un solvant. On dissout l'ensemble à chaud dans le volume
miminum de solvant, puis on laisse refroidir.
Le paracétamol cristallise alors que les impuretés doivent rester dans le solvant.
v) Citer d'autres méthodes de purification couramment utilisées en synthèse organique ?
Distillation fractionnée.
Extraction liquide liquide.
w) Comme le paracétamol (T
fusion = 168°C) est recristallisé dans l'eau. Comment sécher efficacement ce produit après purification ? Justifier.
Chauffer ( mettre à l'étuve).
x) En détaillant, calculer le rendement de la réaction dans le cas où on obtient 6,5 g de paracétamol.
n(paracétamol) théorique =0,050 mol soit 0,050 xM(paracétamol )= 0,05 x151=7,55 g.
Rendement = masse expérimentale / masse théorique = 6,5 / 7,55 ~0,86 ( 86 %).
y) La mesure du
point de fusion permet de confirmer la pureté du paracétamol
synthétisé. Donner le nom de l'appareillage le plus classique utilisé
pour réaliser ce type de mesure. Décrire la démarche à suivre pour
mesurer le point de fusion du paracétamol.
Banc Kofler.
Nettoyer le banc à l'aide d'un coton imbibé d'alcool benzylique.
Allumer le banc et attendre une heure afin qu'il soit suffisamment chaud.
Placer quelques mg de solide à analyser sur le banc. Le déplacer en
biais à l'aide d'une fine spatule jusqu'à observer sa fusion.
z) Quelle technique
chromatographique peut être également utilisée pour confirmer la pureté
du paracétamol synthétisé ? Donner son acronyme en français et en
anglais.
CCM ( TLC en anglais) en vérifiant la présence d'une seule tache.
aa) Quelle est la
phase stationnaire couramment utilisée pour ces analyses
chromatographiques ? Est-elle polaire ou apolaire ? Justifier.
Dans la plupart des cas, la phase stationnaire est polaire ( silice, alumine, cellulose).
ab) Toujours en
utilisant cette technique chromatographique, comment confirmer qu'un
comprimé de doliprane contient du paracétamol ? Détailler la démarche
expérimentale.
Ecraser un comprimé de paracétamol et un comprimé de doliprane.
Dans un verre de montre, en dissoudre une pointe de spatule dans un peu d'éthanoate d'éthyle.
Faire un dépot de paracétamol en A et un dépot de doliprane en B et un mélange des deux en C.
Introduire la plaque dans la cuve. ( éluant éthanoate d'éthyle).
Révéler sous UV.






 6 signaux.
6 signaux.