Structure de la matière.
1 Définir les mots atome et molécule.
Un atome est la plus petite partie d'un corps simple pouvant se combiner chimiquement avec un autre.
Une molécule est une association d'atomes ; la molécule est électriquement neutre.
2) Que signifie les lettres A, Z et X.
AZX : A : nombre de nucléons ; Z ; numéro atomique ; X : symbole de l'atome.
3) Pour l'atome suivant donnez le nombre de neutrons et d'électrons. Quel est son nom ?
2311Na : atome de sodium ; 11 électrons et 23-11 = 12 neutrons.
Réactions chimiques.
4) Qu'est ce que la constante d'équilibre K d'une réaction ? Comment savoir si une réaction est totale ?
K = produit des concentrations des produits divisée par le produit des concentrations des réactifs.
Si K est suffisamment grande, la réaction est totale..
5) On veut doser l'acide acétique par la soude. Indiquer si la réaction est totale.
CH
3COOH + HO
- --> CH
3COO
- + H
2O.
K = [CH3COO-] / ([CH3COOH][HO-]) = [CH3COO-] [H3O+]/ ([CH3COOH][HO- ][H3O+]) = Ka / Ke =1,6 10-5 / 10-14 =1,6 109.
K est grande, la réaction est totale.
Dosage pH-métrique.
Dans
Vb = 20,0 mL d'une solution d'ammoniac de concentration Cb inconnue, on
verse progressivement un volume Va d'acide chlorhydrique de
concentration Ca = 2,5 10
-2 mol / L.
6. Définisser les coumples acide base et écrire leur demi-équation.
H
3O
+ aq / H
2O(l) :
H3O+ aq= H2O(l) +H+aq.
NH4+ aq / NH3(aq) : NH4+ aq= NH3(aq) +H+aq.
H3O+ aq +NH3(aq)= H2O(l) +NH4+ aq.
7) Tracer la courbe pH=f(Va) et donner les coordonnées du point équivalent.
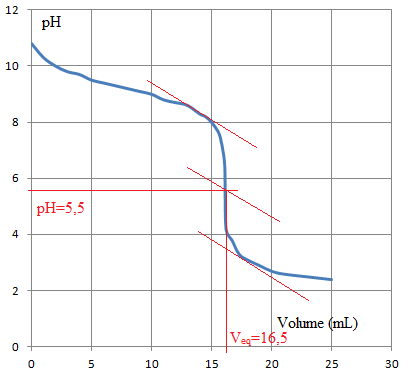 8)
8) Calculer Cb.
Cb = Ca V
éq / Vb =2,5 10
-2 x 16,5 / 20 =2,1 10
-2 mol / L.
1000 x10
5 =10
8 Pa ; 10
8 /101325=987
atm.
9) Pour un dosage colorimétrique, quel indicateur choisir ?
La zone de virage de l'indicateur doit contenir le pH du point équivalent, soit 5,5.
Le rouge de méthyle [4,2 ; 6,3] convient. La solution passe du jaune au rouge.
Nomenclature.
10) Donner les formule semi-développées des composés suivants.
Ethanoate de méthyle : CH
3-COO CH
3.
isobutanol. (CH
3)
2 CH-CH
2OH.
Octane : CH
3-(CH
2)
6-CH
3.
acide pentanoïque : CH
3-(CH
2)
3 COOH.
Triméthylamine : (CH
3)
3 N.
2-hexanone : CH
3-CO-(CH
2)
3-CH
3.
Détermination d'ion en solution.
Ion chlorure : précipité blanc avec AgNO
3.
Ion sulfate :
précipité blanc avec BaCl2.
Ion cuivre (II) : précipité bleu avec NaOH.
Ion fer (II) : précipité vert avec NaOH.
Ion zinc (II) : précipité blanc avec NaOH.
Ion fer (III) : précipité rouille avec NaOH.
11) Ba
2+aq + SO
42- aq--> BaSO
4(s).
Fe
2+aq +2HO
-aq --> Fe(OH)
2.(s).
12) Ag
+aq +Cl
-aq --> AgCl(s).
Fe
3+aq + 3HO
-aq --> Fe(OH)
3 (s).
Pictogrammes.
13. Nommer les pictogrammes suivants :
 Electricité
Electricité.
14) Citer la loi d'Ohm avec les unités.
U = R I ; U : tension en volt ; R résistance en ohm et I intensité en ampère.
15) Schématiser
un circuit comprenant une pile de 5 V, trois résistances en série de
valeur 100 ohms, 250 ohms et 150 ohms. Calculer la résistance
équivalente ainsi que l'intensité.
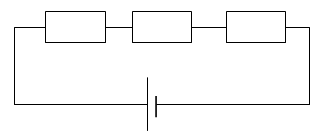
Réqui = 100 +250 +150 = 500 ohms ; I = 5 / 500 = 0,01 A.
16) Schématiser
un circuit comprenant une pile de 5 V, 2 résistances en parallèle de
valeur 20 ohms et 5 ohms. Calculer la résistance
équivalente ainsi que l'intensité.
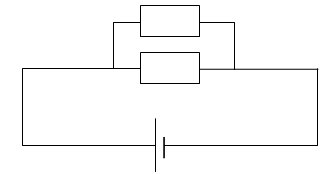
1/ R
équi = 1 /5 +1/20 = 5/20 ; R
équi = 20 /5 = 4 ohms.
I = 5 / 4 = 1,25 A.
8 Oscilloscope.
Sensibilité verticale 2 V / div ; sensibilité horizontale 20 ms / div.
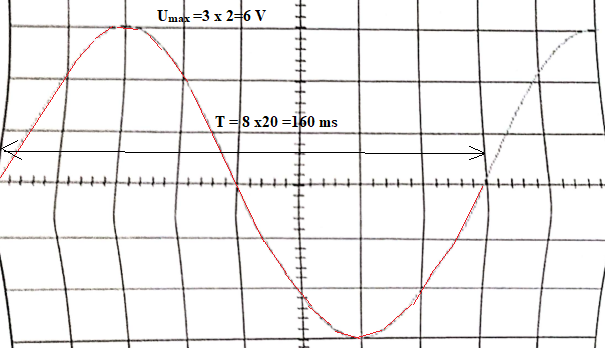
17)Qualifier cette tension.
Alternative sinusoïdale.
18) Indiquer le motif élémentaire ( en rouge ci-dessus), la période et la fréquence.
T = 0,16 s ; f = 1/T = 1/0,16 =6,25 Hz.
Absorbance.
19. Citer la loi de Beer-Lambert avec les noms et unités.
A= elc ( A est l'absorbance ou densité optique)
où e est un coefficient caractéristique de la substance appelé coefficient d'absorbance (L mol-1 cm-1), l est l'épaisseur de la cuve (cm) et c la concentration de la solution (mol/L).
20) Calculer c si A =2,3 ;
e = 23000 et l =1 cm.
c = 2,3 / 23000 =1,0 10
-4 mol / L.