Chimie,
le glutathion.
Concours Ecole de Santé des Armées 2023.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
Exercice
1. ( 10 points)
1/ Recopier la molécule de glutathion (GSH) en y faisant figurer les doublets non liants (hors atome S)
2/ Entourer les groupes caractéristiques et les fonctions chimiques présentes. Les nommer (hors fonction thiol -SH).
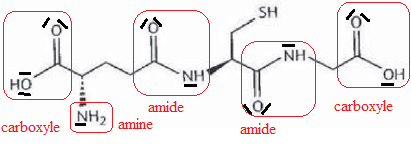
3/ Déterminer la formule brute du glutathion (GSH).
C10H17N3O6S.
4/ Justifier pourquoi l'acide glutamique, la cystéine et la glycine sont des acides aminés.
Ils possèdent une fonction acide carboxylique et une fonction amine.
5/ A propos de la synthèse du glutathion
Une première étape consiste à créer une liaison peptidique en faisant réagir une fonction -NH2
et une fonction -COOH entre l'acide glutamique et la cystéine. A partir
de l'exemple ci-dessous illustrant la réaction de condensation entre la
glycine et l'alanine, prédire quels dipeptides il est possible
d'obtenir en faisant le couplage entre l'acide glutamique et la
cystéine uniquement:
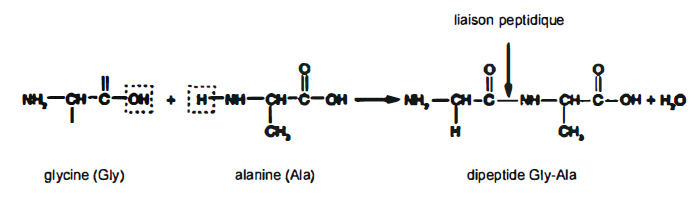
Ces deux acides aminés peuvent conduire à 4 dipeptides
différents.
Dipeptides gly-gly , cys-cys ; gly-cys et cys-gly.
6/ Les différents dipeptides obtenus sont isomères l'un de l'autre . De quelle isomérie s'agit-il ?
Isomérie de constitution, les fonctions étant identiques.
7/ Cette réaction
de couplage entre les deux acides aminés est-elle une réaction de
substitution, d'élimination, acide-base, redox ou d'addition? Justifier.
Réaction entre l'acide R-COOH et la base R'-NH 2 ( réaction acide base) : formation d'un amide et d'eau.
8/ Proposer une méthode permettant d'obtenir le bon dipeptide tel qu'il doit être dans le glutathion.
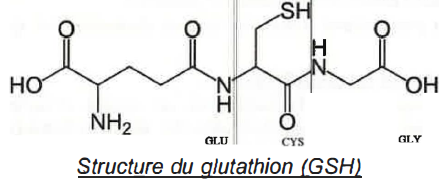
Bloquer la fonction acide carboxylique de la cystéine.
9/ Propriétés oxydo-réductrices du glutathion :
Le glutathion existe sous deux formes, formant ainsi un couple
d'oxydoréduction GSH/GSSG en établissant une liaison entre les deux
atomes de Soufre (S), appelée aussi pont disulfure :
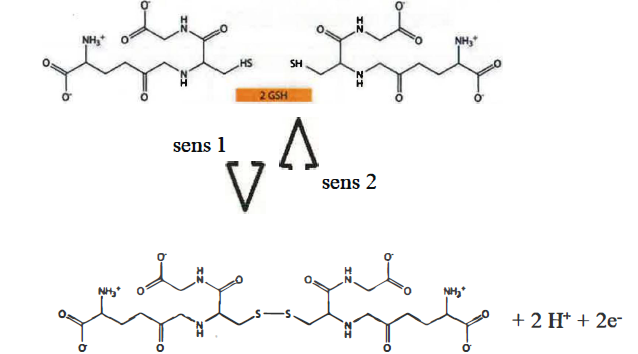
En observant attentivement la demi-équation électronique ci-dessus, en déduire les infos suivantes:
- Quelle est l'espèce oxydante ?
- La réaction dans le sens 1 est-elle une oxydation ou une réduction ?
2GSH conduit à GSSG ( sens 1) en libérant deux électrons : GSH joue le rôle de réducteur qui s'oxyde.
GSSG est donc l'oxydant du couple ( GSSG / GSH).
10/ Propriétés acido-basiques de l'acide glutamique
En fonction du pH du milieu dans lequel il se trouve, l'acide glutamique existe sous plusieurs formes ionisées.
Etablir le diagramme de prédominance de ces différentes espèces en
fonction du pH. Quelle est la charge nette globale de la forme
majoritaire à pH =7,4 appelé pH physiologique ?
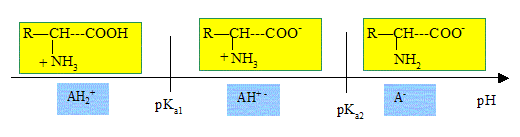
pKa1 = 2 ; pKa2 = 4,3 ; pKa3 = 9.
A pH = 7,4, la forme majoritaire est globalement neutre.
|
...
|
....
|
Exercice 2 QCM.( 10 points).
QCM 1 (1 point) :
Parmi les 4 molécules suivantes, laquelle ou lesquelles peuvent correspondre à ce spectre IR ?
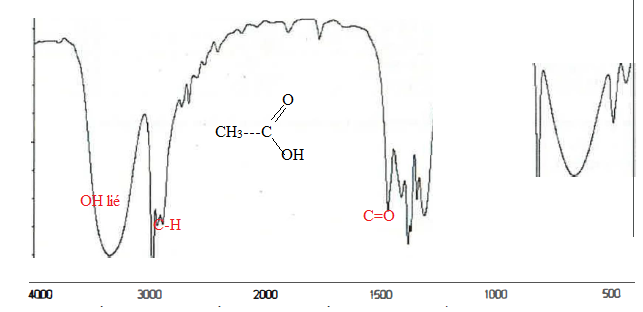
QCM 2 (1,5 point) :
Pour
identifier si ces 4 acides notés respectivement A, B, C et D sont des
acides forts, on a réalisé des solutions de différentes concentrations
dans l'eau distillée et on a mesuré le pH à 25°C.
acide
|
quantité dissoute
|
volume de la solution
|
concentration C ( mol/L)
|
pH mesuré
|
|
A = HNO3
|
10,0 mmol
|
1,00 L
|
0,010 ; log (0,01) = -2
|
2,0
|
acide fort
|
B = HCl
|
15,0 mmol
|
500 mL
|
0,03 ; ( log 0,03) =-1,5
|
1,5
|
acide fort
|
C=CH3COOH
|
10,0 mmol
|
1,0 L
|
0,010 ; log (0,01) = -2 |
3,3
|
acide faible
|
D = HBr
|
80,0 µmol
|
250 mL
|
3,2 10-4 ; log(3,2 10-4) = -3,5
|
3,5
|
acide fort
|
Parmi ces propositions laquelle ou lesquelles correspondent à des acides forts.
A, B et D sont des acides forts ( réponse D).
A. L'énergie
interne du gaz tient compte de l'énergie potentielle de pesanteur du
ballon. Faux.
B. L'énergie
interne du gaz tient compte de l'énergie cinétique du ballon lors du
mouvement. Faux.
C. L'énergie
interne d'un gaz parfait tient compte de l'énergie d'interaction entre
les molécules. Vrai.
D. La température
est la résultante des forces des chocs des molécules sur les parois du
ballon. Faux.
QCM 7 et 8 (3 pts)
Soit une pile constituée de 2 béchers l'un contenant un fil de Nickel qui trempe dans une solution de volume 25 mL d'ions [Ni2+] de concentration 0, 1 mol.L-1 et l'autre contenant un fil d'Argent qui trempe dans une solution de volume 25 mL d'ions [Ag+] de concentration 0, 1 mol.L-1.
Ces 2 béchers sont reliés par un pont salin
Données : couples rédox : Ni2+/Ni et Ag+/Ag
La réaction qui a lieu est 2Ag+(aq)+ Ni(s) ---> 2Ag(s) + Ni2+(aq).
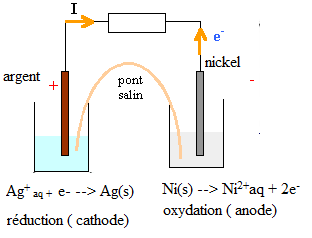
Parmi les propositions suivantes, indiquez celle(s) qui est (sont) exacte(s).
A. L'ion Argent Ag+ est le réducteur. Faux.
L'ion Ag+ gagne un électron, c'est un oxydant qui se réduit.
B. Les électrons partent du fil de nickel. Vrai.
Ni(s) est le réducteur, il s'oxyde en libérant deux électrons.
C. Le pont salin permet aux électrons de passer de la solution d'ions Ni2+ à la solution d'ions Ag+ Faux.
Les électrons ne se déplacent que dans les conducteurs métalliques.
D. L'électrode d'argent est la cathode. Vrai.
L'ion argent se réduit ; l'électrode d'argent est le siège d'une réduction.
E. L'anode est le siège de la réduction. Faux.
Le nikel s'oxyde, il constitue l'anode négative.
QCM 8 (1,5 pts):
Sachant que la constante d'équilibre de la réaction est K= 1025
Parmi les propositions suivantes, indiquez celle(s) qui est (sont) exacte(s).
Qr i =[Ni2+(aq) ]i / [Ag+(aq) ]2i = 0,1 / 0,12 = 10.
A. A l'instant initial on a dans ce cas Qr i= 0
B. A l'instant initial on a Qr i= 10. Vrai.
C. A l'instant initial on a Qr i= 1025
D. A l'instant initial la réaction est déjà à l'équilibre.
E. La réaction se fait dans le sens direct. Vrai.
Qr i < K.
QCM 9 (1,5 pts) :
Soit une solution de volume 500 mL constituée de 0,05 mol d'hydroxyde
de potassium qui a les mêmes propriétés basiques que l'hydroxyde de
sodium
Données : pKe= 14 ; log(10-3)= - 3 ; log(0,05) = -1,3 ;log(0,25) = -0,6
Son pH à 25°C est de :
A. pH=1,0
B. pH= 13,4
C. pH=13,0. Vrai.
D. pH=1,3
E. pH= 12,7.
pH = 14 + log (C) = 14 +log (0,05 / 0,5) =14 +log(0,1) = 14-1 = 13.
QCM 10 (1 ,5pts):
Dans les couples de moléculés suivantes, les composés représentés sont-ils isomères de constitution ?
( même formule brute et formules semi-développées différentes).
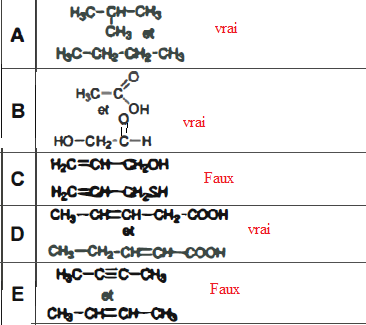
QCM 11 (1 ,5pts):
On précise dans un premier temps l'équation générale de la réaction d'estérification entre un acide carboxylique et un alcool.
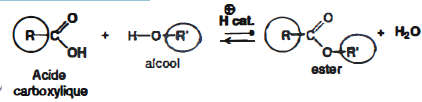
Les composés suivants peuvent-ils être obtenus par réaction d'estérification entre l'acide indiqué et l'éthanol de formule CH3-CH2OH ?
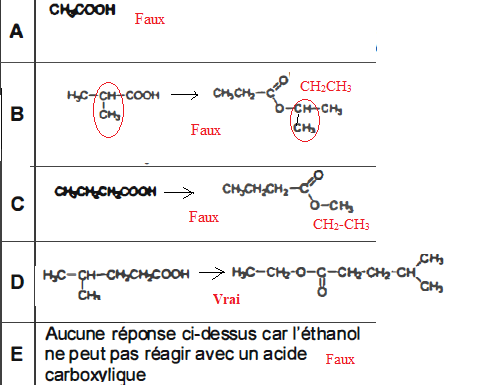
|
|









