Corrigé
chimie, l'émail, le bain de bouche,
Concours CAPLP maths sciences 2023.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
L'émail dentaire.
A.1. L'hydroxyapatite.
1. On note N la
nombre de motifs dans la maille élémentaire de la structure hexagonale.
Justifier que N = 2.
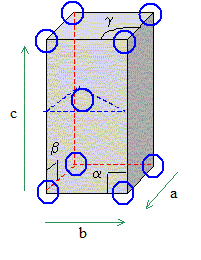
|
Dessin de la maille
conventionnelle ( 1/3 de la figure hexagonale ) que l'on utilise pour
décrire une structure hexagonale dans le cas général.
Relations particulières
vérifiées par les paramètres d'une telle maille.
a=b ; c différe de a et
de b.
a=b=90° ; g= 120°.
1 noeud : sommet
du parallélépipède construit à partir des vecteurs de base a, b, c. (
chaque sommet appartient à 8 mailles et compte pour 1/8)
Nombre d’atomes par
maille : 2
chaque atome situé à un
noeud appartient à 8 mailles et compte pour 1/8 ; l'atome central
appartient en propre à la maille.
|
2. Exprimer la
masse volumique théorique rHAp
de l’hydroxyapatite Ca5(PO4)3OH(s). En
déduire sa valeur numérique.
a =942 pm ; c=688 pm.
M(Ca5(PO4)3OH) =5 x40,1
+3x(31,0+64,0)+17=502,5 g / mol.
Aire de base : A = a2 3½/2
Volume de la maille : V = 3½a2 c / 2 =1,732 x(942 10-12)2
x 688 10-12 / 2=5,29 10-28 m3.
Masse de la maille m = 2 M (Ca5(PO4)3OH) / NA =2 x0,5025
/(6,02 1023)= 1,67 10-24 kg.
rHAp
= m / V = 1,67 10-24 / (5,29 10-28
)=3,16 103 kg m-3.
3. En pratique, on
observe des variations dans la valeur de la masse volumique de
l’hydroxyapatite. Expliquer.
Les ions hydroxyde HO− peuvent être remplacés par des ions
fluorure F−, chlorure Cl− ou carbonate CO3
2-.
4. Citer une méthode
expérimentale utilisée pour déterminer les paramètres de maille d’une
structure cristalline.
La diffraction des rayons X.
A.2. L’émail dentaire en milieu acide à 37°C.
La déminéralisation de l’émail dentaire, à l’origine des caries, dépend
du pH.
5. Donner le
diagramme de prédominance associé à l’acide phosphorique H3PO4.
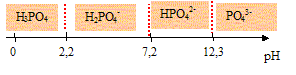
6. Écrire les
expressions des constantes d’acidité Ka2 et Ka3
associées à cet acide.
H2PO4- +
H2O
= HPO42-+
H3O+
. Ka2
= [HPO42-][H3O+]
/ [H2PO4-].
HPO42-
+ H2O
= PO43-+
H3O+
. Ka3
= [PO43-][H3O+]
/ [HPO42-].
7. Écrire
l’équation de dissolution de l’hydroxyapatite en milieu aqueux.
Ca5(PO4)3OH(s)
--> 5 Ca2+aq + 3 PO43-aq +HO-aq. Ks1 =[Ca2+aq]5 [PO43-aq]3 [HO-aq].
8. Indiquer le
pH minimal atteint après un repas.
Le pH chute de 7 à 4,5.
On considère à présent la réaction suivante de l’hydroxyapatite dans
l’eau pour un pH d’environ 5, notée (1) : Ca5(PO4)3OH(s)+7
H3O+(aq)=5 Ca2+(aq)+3 H2PO4−(aq)+8
H2O(l) (1)
9. Montrer que
l’expression littérale de la constante d’équilibre K1
associée à la réaction (1) en fonction de Ks1, du produit
ionique de l’eau Ke et des constantes d’acidité utiles de
l’acide phosphorique est :
K1°=Ks1 / (Ke K3a2
K3a3).
K1°=[Ca2+(aq)]5[H2PO4−(aq)]3/ [H3O+(aq)]7.
Ka2
Ka3=
[PO43-][H3O+]2
/ [H2PO4-].
(Ka2
Ka3)3=
[PO43-]3[H3O+]6
/ [H2PO4-]3.
(Ka2
Ka3)3Ke=
[PO43-]3[H3O+]7
[HO-aq] /
[H2PO4-]3.
Ks1 =[Ca2+aq]5 [PO43-aq]3 [HO-aq].
Ks1 / ((Ka2
Ka3)3Ke)=[Ca2+aq]5 [H2PO4-]3 / ([H3O+]7
.
10. Donner
l’expression littérale puis calculer le quotient de réaction Q1
de la réaction (1) pour la salive à un pH de 5.
Q1 =[Ca2+aq]i5 [H2PO4−(aq)]i3 / [H3O+(aq)]i7.
À un pH d’environ 5, dans la salive :
[Ca2+] = 1 ∙ 10−3 mol ∙ L−1 ; [H2PO4-] = 1 ∙ 10−3 mol ∙ L−1 et [F−] = 1 ∙ 10−5
mol ∙ L−1.
Q1 =10-15 x10-9 / 10-35
=1011.
11. Conclure sur le sens de
l’évolution de la réaction (1). Vérifier si le résultat est en accord
avec la courbe de Stephan.
Ks1(Ca5(PO4)3OH(s)) = 1 ⋅ 10−57
à 37°C.
pKa2 = 6,8 ; pKa3 = 11,7.
K1°=Ks1 /
(Ke K3a2 K3a3)=10-57
/ (10-14 x(10-6,8
10-11,7)3)=1012,5.
Q1 < K1°, donc évolution de la réaction 1 dans
le sens direct.
A.3. Protection de l’émail dentaire.
L’utilisation d’un dentifrice au fluor permet la formation de
fluorapatite de formule chimique Ca5(PO4)3F(s).
12. Montrer pourquoi
l’utilisation d’un dentifrice « au fluor » prévient l’apparition de
caries dentaires.
fluorapatite : Ks2 (Ca5(PO4)3F(s))
= 1 ⋅ 10−60.
Ca5(PO4)3F(s)+6
H3O+(aq)=5 Ca2+(aq)+3 H2PO4−(aq)+6
H2O(l)+F -aq (2)
K2°=[Ca2+(aq)]5[H2PO4−(aq)]3[F -aq] / [H3O+(aq)]6.
Ka2
Ka3=
[PO43-][H3O+]2
/ [H2PO4-].
(Ka2
Ka3)3=
[PO43-]3[H3O+]6
/ [H2PO4-]3.
Ks2
=[Ca2+aq]5 [PO43-aq]3 [F -aq].
Ks2 / ((Ka2
Ka3)3)= [F -aq] [Ca2+aq]5 [H2PO4-]3 / ([H3O+]6
.
K2°=10-60
/ ((10-6,8
10-11,7)3)=10-
4,5.
Q2
=[Ca2+aq]i5 [H2PO4−(aq)]i3 [F -aq]i/ [H3O+(aq)]i6.
Q2 =10-15 x10-9 x10-5
/ 10-30=10.
Q2 < K2°, donc évolution de
la réaction 2 dans le sens inverse.
|
...
|
....
|
Partie C : le bain de bouche.
C.1. Le fluor Les
sources d’ion fluorure varient suivant la marque du bain de bouche :
fluorure de sodium (NaF), fluorure stanneux (SnF2) ou
monofluorophosphate disodique (Na2PO4F).
23. Donner la
configuration électronique de l’ion fluorure. Proposer une explication
à sa stabilité particulière.
fluor F ( Z= 9) : structure
électronique K2L7.
F gagne facilement
un électron et donne l'ion F- dont la couche électronique externe compte
8 électrons K2L8 ( règle de l'octet).
24. Proposer une
formule de Lewis associée au fluorure stanneux sans charge formelle. On
rappelle que l’étain, Sn, est dans la même colonne de la classification
périodique que le carbone.
25. Justifier que
le fluorure stanneux est un acide au sens de Lewis.
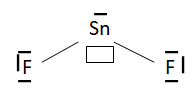
L'étain ne respecte pas la règle de l'octet. La présence d'une orbitale
électronique vide confère au chlorure stanneux un caractère d'acide de
Lewis.
C.2. Le (−)-menthol.
Il existe de nombreux arômes pour les bains de bouche, le plus répandu
étant celui de la menthe. Le (−)-menthol est le constituant principal
de l’arôme menthe fraîche.
26. Interpréter
succinctement le spectre infra-rouge de la molécule du (−)-menthol.
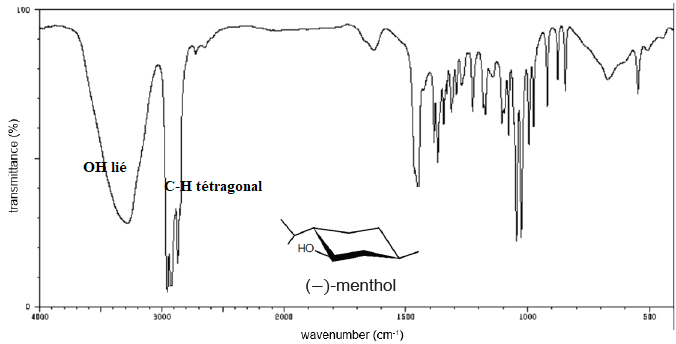
27. Préciser la
signification du symbole « (−) » présent dans le nom usuel (−)-menthol.
Cet énantiomère fait tourner le plan de la lumière polarisée dans le
sens contraire des aiguilles d'une montre.
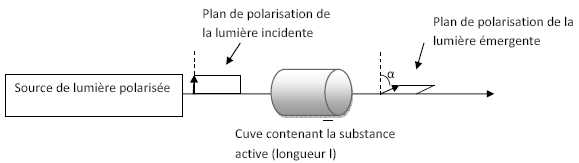
La loi de Biot, dans le cas d’une solution diluée, peut s’écrire :
a=[a]l20 l c.
28. Indiquer ce que
signifient les mentions « l
» et « 20 » dans cette écriture.
a : pouvoir rotatoire
en degrés ; l : longueur de la
cuve en dm ; c : concentration de la substance en g/mL ;
[a]Tl
: pouvoir rotatoire spécifique de la substance active à la température
T et pour un rayonnement électromagnétique de longueur d'onde l exprimé en ° g-1 mL dm-1.
29. Proposer une
méthode pratique permettant de vérifier que le pouvoir rotatoire
spécifique du (−)-menthol est de − 49,5° au lieu de +310,5°.
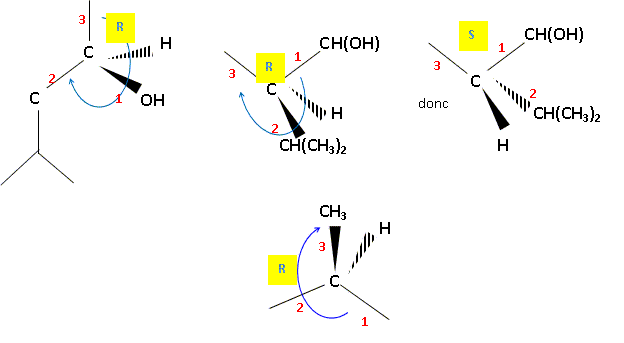
30. Entourer les
centres stéréogènes du (−)-menthol.
31. Identifier le
descripteur stéréochimique (R ou S), de l’un des centres stéréogènes au
choix du (−)-menthol. Justifier la réponse.
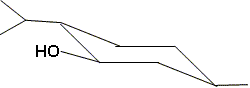
32. Justifier
pourquoi la conformation chaise du (−)-menthol est la plus stable.
Les trois substituants sont en position équatoriale ; la
position équatoriale minimise les interactions avec les atomes
d'hydrogènes voisins. ( l'énergie potentielle est la plus basse )
C.3. Le colorant
E133
Le bain de bouche contient du colorant E133 dont on cherche la
concentration en masse.
33. Justifier, à
partir de sa formule topologique, que cette molécule est un colorant.
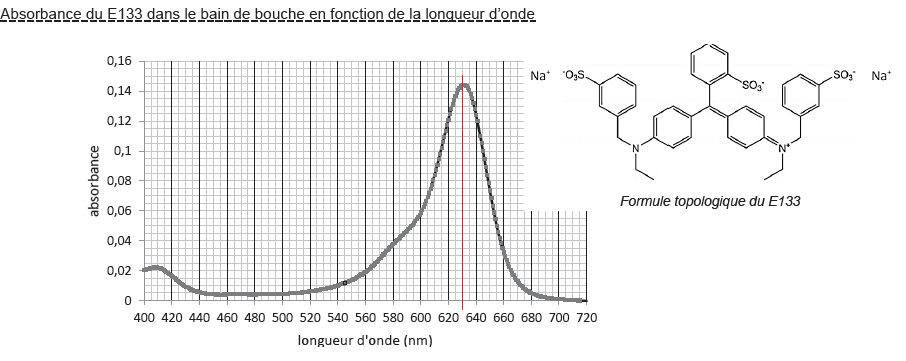
34. Indiquer la couleur
du colorant E133 en solution.
Le E133 présente un maximum d'absorption vers 630 nm ( rouge)
appartenant au domaine visible . C'est donc une molécule colorée. Sa
couleur est complémentaire au rouge soit le bleu cyan.
35. Rappeler la
loi de Beer-Lambert en précisant la signification des différents termes
et leurs unités. Donner une condition de validité de cette loi.
A= log (I0/I) = elc ( A est l'absorbance ou densité optique)
Cette loi est vérifiée lorsque la solution est de
concentration inférieure à : c < 0,1 mol.L-1.
e (L mol-1
cm-1) est une caractéristique de la molécule.
Plus e sera grand, plus la solution absorbe.
l est l'épaisseur
de la
cuve (cm) et c
la concentration de la solution (mol/L).
36. Préciser pourquoi on
choisit en général la longueur d’onde pour laquelle l’absorbance est
maximale lorsqu’on utilise la loi de Beer-Lambert dans divers
protocoles expérimentaux.
Pour une meilleure précision, on se place au maximum d'absorption.
37. Estimer la
concentration en masse de E133 dans le bain de bouche.
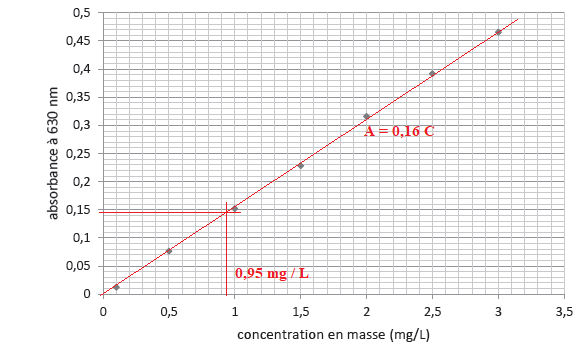
|
|