Exercice I : L’iode et sa composition
L’iode est l’élément de numéro atomique Z=53. Il existe sous la forme
de 37 isotopes dont un seul est
stable, caractérisé par son nombre de neutrons N = 74.
1.1 Que signifie le
terme « isotope » ? Des isotopes ne diffèrent que par leur nombre de
neutrons ; ils ont le même numéro atomique Z.
1.2 Indiquer,
pour l’isotope stable de l’iode, son nombre de :
53 protons ; 53 électrons ; 53+74 = 127 nucléons .
Dans la classification périodique des éléments, l’iode se situe
dans l’avant-dernière colonne avec, entre
autres, le chlore et le brome.
1.3 À quelle
famille chimique appartient l’iode ?
Halogènes.
1.4 Donner le nom
et le symbole chimique de deux autres éléments présents dans la même
colonne
que l’iode.
Fluor, chlore, brome, astate.
Exercice II : Le diiode en
solution
En solution aqueuse, le diiode est très peu soluble : sa solubilité
vaut 330 mg.L
-1
.
1.1 Pour
préparer 50,0 mL d’une solution saturée en diiode, quelle masse
minimale faut-il peser ?
330 x50
/1000 =16,5 mg.
1.2 Calculer
la concentration en mol.L
-1 d’une solution saturée en diiode.
Donnée : masse molaire atomique de l’iode : 126,5 g.mol
-1.
0,330 / 126,5=
2,60 10
-3 mol / L.
Sur l’étiquette du flacon de diiode, on trouve les pictogrammes
suivants.
1.3 Associer à
chaque pictogramme sa signification.

1.4
Quel document doit-on consulter si on souhaite davantage d’informations
sur les dangers et la
conduite à tenir pour manipuler ce produit chimique ?
INRS, fiches de données et de scurité.
Numéro CAS d'une substance chimique.
La solubilité du diiode étant très faible dans l’eau, l’astuce consiste
à rajouter de l’iodure de potassium
au diiode solide : il se forme alors du triiodure I
3
- dont les caractéristiques en solution sont les
mêmes
que le diiode.
1.5 Donner la
formule chimique de l’iodure de potassium. KI.
1.6 Dans la liste des
termes ci-dessous, entourer celui adapté à l’espèce triiodure I
3
-
:
Atome Molécule Cation
Anion
1.7 Préciser les
mesures que vous prendriez pour préparer une solution de diiode.
Port de blouse, gants, travail sous hotte aspirante. Ne rien jeter à
l'évier.
Exercice III :
Utilisation d’une solution de diiode en TP
Un enseignant souhaite faire un TP autour de l’extraction
liquide-liquide : l’objectif du TP est de
séparer un mélange contenant des ions cuivre Cu
2+ et du
diiode.
Un volume V
0=500,0 mL d’une solution S
0 d’ions
cuivre Cu
2+ de concentration C
0=0,1 mol.L
-1
et un
volume V
1=100,0 mL d’une solution S
1 de diiode de
concentration C
1=10
-3 mol.L
-1
sont mélangés pour
constituer le mélange final (solution S).
1.1 En quelques lignes,
décrire le protocole de préparation de la solution S
0. On
précisera en particulier
la masse de sulfate de cuivre pentahydraté à peser.
Donnée : masse molaire du sulfate de cuivre pentahydraté : 249,7 g.mol
-1.
0,05 mol dans 0,5 L soit 0,05 x249,7=12,5 g
Peser 12,5 g de sulfate de cuivre.
Placer dans une fiole jaugée de 500 mL contenant 1/3 d'eau distillée.
Agiter jusqu'à dissolution complète.
Compléter avec de l'eau distillée jusqu'au trait de jauge. Agiter pour
rendre homogène.
1.2 Calculer les
concentrations en ions Cu
2+ et en diiode dans le mélange
final (solution S) en mol.L
-1
.
[Cu
2+] =V
0C
0 /(V
0+V
1)=500
x0,1 / 600=8,33 10
-2 mol / L.
[I
2]=
V1C1
/(V0+V1)=100 x10-3 / 600=1,67 10-4
mol / L.
On donne quelques caractéristiques de solvants disponibles au
laboratoire.
1.3 Expliquer
pourquoi on ne peut pas utiliser l’éthanol comme solvant d’extraction.
L'eau et l''éthanol sont miscibles.
1.4 Quel solvant
d’extraction choisirez-vous entre le dichlorométhane et le cyclohexane
? On justifiera
le choix.
Dichlorométhane :
nocif , risques graves pour la santé.
Cyclohexane :
nocif ,
risques graves pour la santé, inflammable et dangereux pour
l'environnement..
1.5 Pour
chaque résidu de ce TP, indiquer le bidon de récupération adéquat. On
dispose des bidons
suivants : acides, bases, sels métalliques, solvants halogénés,
solvants non halogénés, évier.
Solution de sulfate de cuivre : sel métallique.
Cyclohexane : solvant non halogéné.
Dichlorométhane solvant halogéné.
La verrerie utilisée pour l’extraction est schématiséeci-dessous.
1.6 Quel est le nom de
cette verrerie ?
Ampoule à décanter.
1.7 Annoter le
schéma en précisant les compositions de chaque phase à l’issue de
l’extraction.
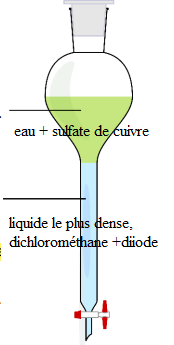 1.8
1.8 Proposer un protocole
permettant de confirmer les valeurs des densité des différents solvants.
Peser un volume V = 100 mL de chaque solvant. Comparer à la valeur
trouvée pour l'eau.
Exercice IV : Étalonnage
d’une solution de diiode
Pour étalonner une solution de diiode, on procède en deux étapes :
titrage d’une solution contenant
des ions thiosulfate puis titrage de la solution de diiode à l’aide de
la solution titrée de thiosulfate.
A - Titrage d’une solution
de thiosulfate de sodium
Pour le titrage, on utilise comme étalon de l’iodate de potassium de
formule KIO
3.
1.1 Calculer la
masse molaire moléculaire de l’iodate de potassium.
Données : masses molaires atomiques (g.mol
-1
) O : 16,0 K : 39,1 I : 126,9
39,11+126,9+3x16,0=214 g/mol.
Dans un cahier de laboratoire, on trouve le protocole suivant «
Préparer une solution en iodure de
potassium de concentration C
iodure=0,1 mol.L
-1
. Peser une masse m
iodate dans une coupelle puis la
dissoudre dans une fiole jaugée de 50,0 mL. Prélever un volume V
iodate=10,0
mL, un volume V
iodure=5 mL
puis ajouter 10 mL d’une solution d’acide sulfurique à 1 mol.L
-1
: la solution doit passer du jaune-orangé
à l’incolore. Doser cette solution par la solution de thiosulfate
contenue dans la burette »
1.2 Compléter les
lignes suivantes en indiquant pour chaque prélèvement la verrerie la
plus adaptée :
Iodate : pipette jugée 10,0 mL
Iodure : pipette jaugée 5,0 mL.
Acide sulfurique :pipette graduée 10 mL.
1.3 Donner la
formule brute de l’acide sulfurique.
H
2SO
4.
1.4 L’acide
sulfurique peut être considéré comme un diacide fort : que signifient
ces termes ?
L'acide sulfurique réagit totalement avec l'eau en libérant deux
ions H
+aq.
Pour préparer la solution d’iodure de potassium, on dispose au
laboratoire d’une solution de
concentration 0,5 mol.L
-1
.
1.5 Quel est le
nom donné à l’opération consistant à préparer une solution à partir
d’une solution plus
concentrée ? Dilution.
1.6 Quel
volume de cette solution mère à 0,5 mol.L
-1
faut-il prélever pour préparer 100,0 mL d’ une
solution en ion iodure à 0,1 mol.L
-1
?
Facteur de dilution 0,5 /0,1 =5.
Il faut prélever 100 /5=20,0 mL de solution mère.
1.7 Ecrire les
demi-équation relatives aux couples en présence.
Données : couples mis en jeu I
2 (aq) /I
-
(aq) et IO
3
-
(aq) / I
2 (aq).
5 fois { 2I
-aq
=
I2aq + 2e- }
2IO3
- aq +12H+aq +10e- = I2 (aq)+ 6H2O(l)
1.8 En déduire la
réaction entre les ions iodure et iodate.
2IO3
- aq +12H+aq +10e-
+10I-aq= I2 (aq)+
6H2O(l) +5I2aq + 10e-.
2IO3
- aq +12H+aq +10I-aq=6 I2 (aq)+
6H2O(l) .
1.9 Entourer le terme
qui caractérise cette réaction :
acide/base
oxydoréduction
complexation précipitation.
1.10 Pourquoi le
protocole précise-t-il d’ajouter de l’acide sulfurique dans la solution
? L'acide sulfurique est l'un des réactifs, il ne doit pas être en
défaut.
1.11 Écrire la relation
liant la quantité de matière initiale en iodate n
iodate et
la quantité de diiode
formée n
I2.
nI2
= 3 niodate.
.
L’équation de dosage s’écrit : I
2 (aq) + 2 S
2O
3
2-
(aq) --> S
4O
6
2-
(aq) + 2 I
-
(aq).
1.12 Ecrire la
relation liant la quantité de matière formée n
I2 et la
quantité de matière ajoutée à
l’équivalence n
thiosulfate.
nthiosulfate.=2nI2.
On souhaite un volume équivalent aux alentours
de 15 mL.
1.13 En déduire
qu’il faut peser une masse de l’ordre de 0,05 g d’iodate de potassium.
Donnée : la concentration de la solution de thiosulfate de sodium vaut
environ 0,1 mol./ L.
nthiosulfate.=15 x0,1 = 1,5 mmol ; nI2 = 0,75
mmol.
niodate = 0,75 / 3 =
0,25 mmol.
0,25 M(Iodate de potassium) = 0,25 x214 =54 mg ou 0,05 g.
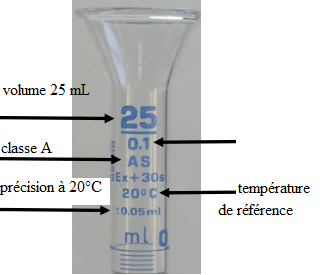
1.14
On dispose au laboratoire de la verrerie suivante : annoter cette photo.
 B - Vérification d’une
solution de Lugol
B - Vérification d’une
solution de Lugol
Une solution de Lugol, appelée également solution d’iodure de potassium
iodée ou encore eau iodée,
fait partie de la liste des médicaments essentiels de l’OMS grâce à son
effet antiseptique. Un
enseignant souhaite faire avec ses élèves le dosage d’une solution de
Lugol. Il vous indique une partie
du protocole dont les élèves disposent :
on place la solution aqueuse de thiosulfate de sodium titrée
dans une burette graduée de 25 mL.
On introduit dans un erlenmeyer un volume V
0= 20,0 mL
de la
solution de Lugol.
On ajoute 20 mL d'eau distillée, mesurée à l’éprouvette graduée.
On verse la solution
de thiosulfate de sodium jusqu’à observer un changement de couleur.
On fera deux dosages : un
grossier puis un précis, à la goutte près ».
2.1 Evaluer le
volume de solution de thiosulfate de sodium à préparer pour que
l’enseignant fasse son
TP. On précise que l’enseignant dispose d’une seule classe, avec 2
groupes de 8 binômes.
Par binôme 2 x25 = 50 mL
16 x50 =800 mL.
2.2 En déduire la
masse de thiosulfate de sodium à peser pour préparer cette solution.
Données :
Masse molaire moléculaire du thiosulfate de sodium : 248,2 g.mol
-1
La concentration de la solution de thiosulfate de sodium vaut environ
0,10 mol./ L.
Pour préparer 1
L soit 0,10 mol, il faut peser 0,10 x 248,2 = 24,8 g de thiosulfate de
sodium.
Les élèves ont obtenu les volumes équivalents suivants (en mL) :
16,00 ; 15,90 ; 15,95 ; 15,90 ;
16,00 ; 16,05 ;16,00 ; 15,95 ; 8,00.
2.3 Calculer la
valeur moyenne des volumes équivalents cohérents.
15,97 ~16,0 mL.
2.4 En vous aidant
de la réponse précédente, calculer la masse de diiode contenue dans le
prélèvement de 20,0 mL de Lugol.
Données :
Masse molaire atomique de l’iode : 126,9 g.mol
-1
La concentration de la solution de thiosulfate de sodium vaut 1,01.10
-1
mol.L
-1
.
L’équation de dosage est I
2 (aq) + 2 S
2O
3
2-
(aq) → S
4O
6
2-
(aq) + 2 I
-
(aq).
n(
S2O3
2-
)=
15,97 x 0,101=1,61 mmol.
n(I
2) =1,61 / 2 =0,806 mmol dans 20,0 mL de lugol.
masse de diiode : 0,806 x126,9=102 mg ou 0,102 g.
2.5 En déduire la
masse contenue dans 1 L de solution.
0,102 x1000 / 20 =5,1 g.
2.6 Le Lugol existe
sous forme de solution à 1 %, 2 % et 5 % (m/m) : quelle forme a été
utilisée pour le
TP ?
Solution à 5 % ( 5 g de lugol dans 100 g de solution).
Exercice V : Étude
cinétique de la décomposition de l’eau oxygénée
A - Préparation de la
cinétique
On donne le spectre d’absorption d’une solution de diiode en
milieu ion iodure.
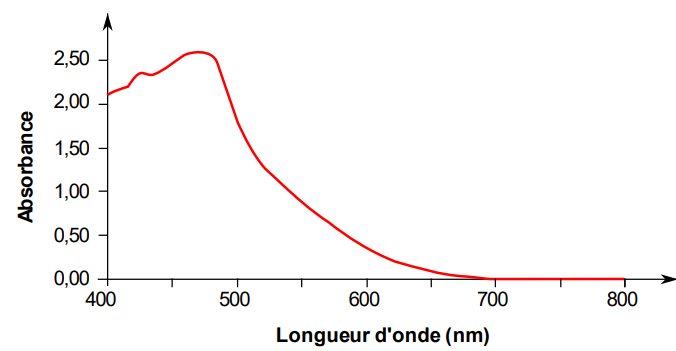 1.1
1.1 Quel est le nom
de l’appareil qui a permis d’obtenir ce spectre ? Spectrophotomètre UV
visible.
1.2
L’ordonnée est l’absorbance : quelle autre grandeur aurait-on pu
utiliser ?
La proportion de lumière transmise ou la proportion de lumière absorbée.
1.3 Dans quel
domaine du spectre électromagnétique a-t-il été tracé ?
400 à 700 nm, domaine visible.
Pour les élèves, on ne dispose pas de l’appareil de la question 1.1
mais de colorimètres dont on peut
régler la longueur d’onde sur quelques valeurs.
1.4 Indiquer la
valeur de la longueur d’onde
appropriée pour ce suivi cinétique (on justifiera brièvement la
réponse).
Pour une meilleur précision, on se place au maximum d'absorption, vers
480 nm.
Pour relier absorbance et concentration en diiode, on prépare plusieurs
solutions.
Solution
|
1
|
2
|
3
|
4
|
5
|
6
|
Volume
solution mère (mL)
|
0
|
2
|
4
|
6
|
8
|
10
|
Volume
eau distillée
|
Quantité suffisante
pour 10,0 mL
|
Concentration
diiode ( mol / L)
|
0
|
0,4
10-3
|
0,8
10-3
|
1,2
10-3
|
1,6
10-3
|
2,0
10-3
|
1.5 Quel est
l’intérêt de la solution n°1 ?
Faire le blanc. Mesure de l'absorbance du solvant.
1.6 Quelle loi est
mise en évidence ? On précisera le nom, la formule de la loi ainsi que
les noms et
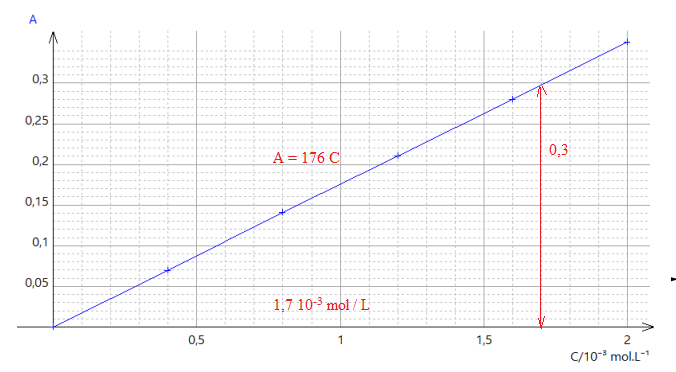
unités usuelles des grandeurs qui apparaissent. Loi de Beer Lambert.
A= log (I0/I) = elc (
A est l'
absorbance ou densité
optique)
où
e est un coefficient
caractéristique de la substance appelé coefficient d'absorbance (
L mol-1 cm-1),
l est l'épaisseur
de la cuve (
cm) et
c la concentration de la solution (
mol/L).
1.7 En déduire une
relation numérique entre l’absorbance et la concentration en diiode [I
2].