Physique
chimie, acide aminé, fluorophore,
BTS 2023 biotechnologies.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
Acides a-aminés.
1. Nommer les fonctions chimiques
présentes.
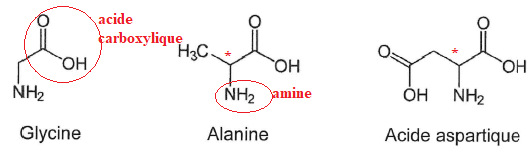 2.
2. Justifier le caractère amphotère.
Présence de la fonction acide carboxylique : ils se comportent comme un
acide.
Présence de la fonction amine : ils se comportent comme une base.
3. Le solutions
d'acides a aminés
ont la propriété de faire tourner le plan de polarisation d'une lumière
à l'exception de la glycine. Justifier.
La glycine est le seul acide a
aminés qui ne possède pas d'atome de carbone asymétrique.
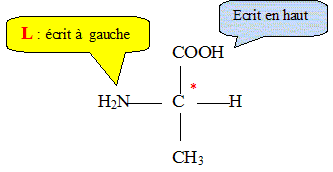
4. Donner la
représentation de Fischer de la L-alanine.
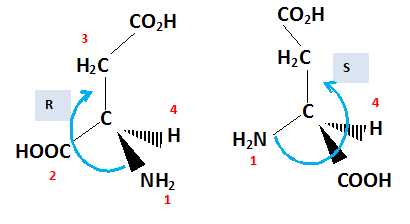
5. Donner la
représentation de Cram de l'énantiomère de configuration R de l'acide
aspartique..
Titrage pH-métrique de
l'acide aspartique.
On considère une solution de volume Va = 50,0 mL d'acide aspartique
dans laquelle il se trouve sous forme d'un zwitterion noté H2Aaq.
On ajoute un volume Vb de solution d'hydroxyde de sodium de
concentration Cb =0,100 mol / L.
H2A aq + HO-aq --> HA-aq +H2O
(1)
HA-aq
+ HO-aq --> A2-aq
+H2O (2).
6.
Justifiier que la forme H 2A aq est majoritaire avant le
titrage.
H 3A +aq /H 2Aaq pKa1 = 2,0.
H2Aaq
/HA-aq pKa2 = 3,9.
HA-aq /A2-aq pKa3 =
10,0.
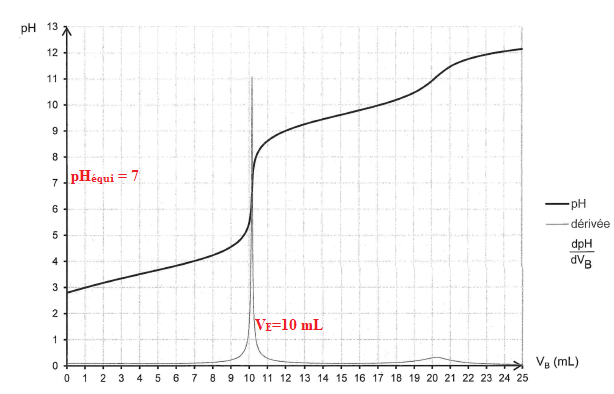
pH initial = 2,9 ; à pH compris entre pKa 1 =2,9 et pKa 2=3,9,
la forme H 2A est majoritaire.
7. Exprimer la
constante K1 de la réaction (1) en fonction de Ka 2 et K E
puis la calculer. Conclure.
K1 = [ HA-aq]
/ ([ H2A aq
] [ HO-aq
])= [ HA-aq] [ H3O+aq]/ ([H2A
aq ] [HO-aq
]H3O+aq]) =Ka2 / KE.
K1 = 10-3,9 / 10-14
= 1010,1.
K1 est très grande, la réaction est totale.
8. Déterminer la
masse d'acide aspartique initialement présente en solution aqueuse.
A l'équivalence : Va Ca = Cb Véqui ; Ca = 0,100 x 10,0 / 50,0 =0,020
mol / L.
M(H2A) =133,9 g / mol.
0,020 x133,9 =2,68 g / L soit 0,134 g dans 50 mL.
9. La solution
aqueuse d'acide aspartique est limpide. Montrer que cette observation
est en accord avec sa solubilité ( 4,5 g / L).
2,68 g / L est inférieur à la solubilité de cet acide. Donc la solution
est limpide.
10. Proposer un
indicateur coloré pour ce titrage.
La zone de virage de l'indicateur doit contenir le pH du point
équivalent ( soit environ pH=7). Le bleu de bromothymol convient.
Marquage des protéines par des noyaux
radioactifs.
L''iode 125 est utilisé.
L'activité initiale d'un échantillon de protéines marquées est A0
= 20 MBq.
1. Donner la composition du noyau
d'iode 12553I.
53 protons
et 125-53 =72 neutrons.
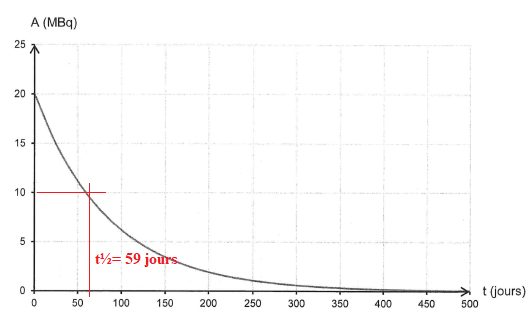
2. Définir le temps
de demi-vie et le déterminer graphiquement.
Le temps de demi-vie t½ est la durée au bout de laquelle l'activité
initiale est divisée par 2.
3. Calculer la
longueur d'onde l
du rayonnement émis par l'iode 125.
Energie libérée E =35,5 keV = 35,5 103 x1,6 10-19
=5,68 10-15 J.
E = hc / l ; l = h c / E =6,63 10-34
x3,00 108 /(5,68 10-15) =3,50 10-11 m.
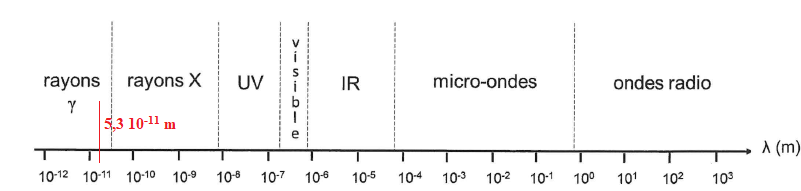
4. Justifier
que ce rayonnement appartient au domaine gamma.
5. L'activité est
négligeable si A / A0 < 0,01. Calculer la durée
correspondante.
A = A0 exp(-0,0115t) ; A / A0 = exp(-0,0115t)
<0,01.
-0,0115t < ln(0,01) ; t > 400 jours.
Pour marquer d'autres acides aminés on peut utiliser un noyau de
tritium 31H. Le noyau fils est 32He.
6. Ecrire
l'équation de la désintégration.
31H--> 32He + -10e
+ antineutrino. Un électron est émis ( radioactivité de type ß-).
|
|