Physique
chimie, ibuprofène, dosage de la bilirubine,
BTS 2023 analyse de biologie médicale.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
Principe actif de l'ibuprofène C13H18O2. 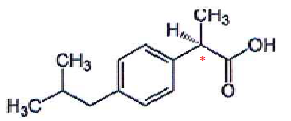 1.
1. Définir atome de carbone asymétrique.
Atome de carbone tétragonal lié à 4 atomes ou groupes d'atomes différents.
2. Définir stéréoisomère.
Molécules de même composition atomique qui ne diffèrent ue par la disposition de leus atomes dans l'espace. 3. Quel isomère 1 ou 2 a une efficacité médicamenteuse ? Justifier.
Seul l'isomère S a une activité médicamenteuse.
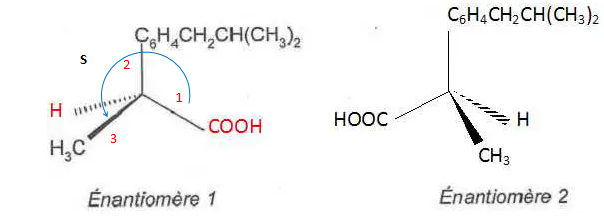 4. 4. Définir acide au sens de Brönsted.
Un acide est une espèce suceptible de libérer un proton H +.
5. Nommer le groupe fonctionnel conférant cette propriété à l'ibuprofène.
Groupe carboxyle COOH, fonction acide carboxylique.
6. On note R-COOH l'ibuprofène. Ecrire le couple acide base correspondant..
R-COOH / R-COO-.
7. Ecrire l'équation modélisant la réaction de l'ibuprofène avec l'eau.
R-COOH aq + H 2O(l) = R-COO -aq + H 3O +aq.
8. Le pH de l'estomac est environ pH = 2. Sous quelle forme se trouve l'ibuprofène dans l'estomac ?
pKa ( R-COOH / R-COO-) =4,5.
A pH < pKa, la forme acide R-COOH prédomine.
Synthèse de l'ibuprofène.
9. Indiquer le type et la nature de la réaction mise en jeu dans l'étape 1.
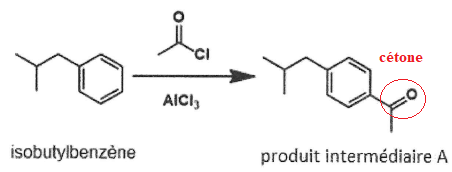
Substitution électrophile sur le noyau benzénique.
10. Nommer la nouvelle fonction organique formée dans le produit intermédiaire A et dans le composé intermédiaire B.
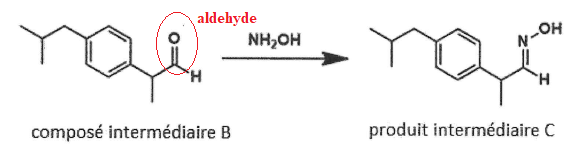 L'ictère, un effet secondaire de l'ibuprofène.
L'ictère, un effet secondaire de l'ibuprofène.
Cette pathologie est liée à l'excès de bilirubine dans l'organisme. La bilirubine est dosée par spectrophotométrie.
10. On considère une diode au silicium pour laquelle le gap vaut DE = 1,10 eV = 1,10 x1,6 10-19 =1,76 10-19
J. Montrer que la radiation qui doit éclairer cette photodiode pour la
rendre conductrice doit avoir une longueur d'onde maximale lmax = 1,13 103 nm.
DE = h c / l ; l = hc / DE =6,63 10 -34 x3,0 10 8 /(1,76 10 -19)=1,13 10 -6 m = 1,13 103 nm.
On représente le schéma en coupe d'une photodiode et le trajet suivi
par la lumière qui arrive sur la photodiode. Cette dernière comporte
une lentille.
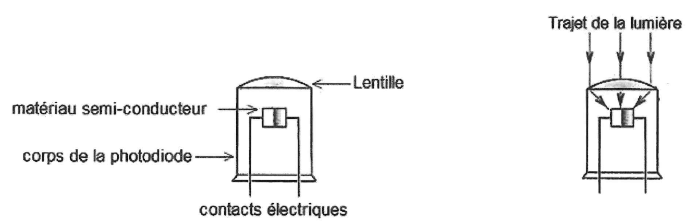
12. Indiquer la nature et le rôle de cette lentille.
La lentille convergente focalise la lumière incidente sur le matériau semi-conducteur.
Chaîne de mesure.
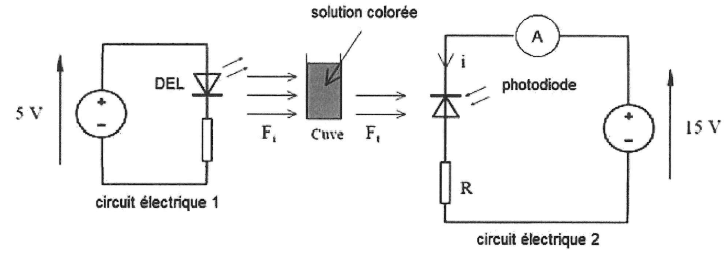
L'ensemble est mis dans une enceinte noire. le circuit 1 alimente une
DEL qui émet une lumière colorée quasimonochromatique. Le circuit 2
comporte une photodiode polarisée dans le sens bloquant. On mesure
l'intensité du courant électrique inverse, dû à l'éclairement de la
photodiode, dans le circuit 2.
13 A quels éléments correspondent les circuits électriques 1 et 2 ?
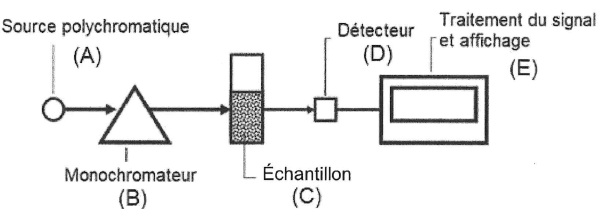
Le monochromateur B permet de sélectionner une longueur d'onde de travail : circuit 1.
Le détecteur D transforme le flux lumineux en signal électrique : circuit 2.
14. Expliquer en quoi le montage permet de réaliser des mesures d'absorbance.
Absorbance A = log( Fi / Ft).
Fi flux énergétique incident ; Ft : flux énergétique transmis après traversée du milieu.
L'intensité du courant électrique ( circuit 2) est proportionnelle au flux Ft.
|
| .
. |
....
|
Protocole de dosage de la bilirubine.
15. A quoi sert la centrifugation lors de l'obtention du sérum ?
La centrifugation permet d'éviter l'hémolyse ( destruction des hématies) lors de l'obtention du sérum.
16. Expliquer pourquoi on utilise une centrifugation plutôt qu'une décantation.
Décantation : si un mélange hétérogène solide-liquide reste au repos
quelques heures, les particules lourdes tombent au fond du récipient.
Les particules légères restent en surface.
Centrifugation : c'est une décantation perfectionnée qui permet de ganer du temps dans un laboratoire d'analyse.
17. Expliquer le terme " nombre de g".
En centrifugation le nombre de g correspond à des vitesses de rotation
18. Proposer en justifiant la couleur de l'azobilirubine.
L'azobilirubine présente une absorbance maximale à 540 nm. ( couleur
verte jaune). L'azobilirubine a la couleur complémentaire du vert
jaune, soit le rouge violet.
19 Expliquer pourquoi la concentration de la bilirubine présente est proportionnelle à l'absorbance de l'azobilirubine.
La transformation de la bilirubine en azobilirubine se fait mole à mole.
L'absorbance est proportionnelle à la concentration. ( Loi de Beer-Lambert).
20. Démontrer la relation suivante.
Absorbance de l'étalon = k fois concentration de l'étalon. ( k est une constante).
k = Absorbance de l'étalon / concentration de l'étalon.
Absorbance de la bilirubine totale = k fois la concentration de la bilirubine totale.
Concentration de la bilirubine totale = Absorbance de la bilirubine totale / k.
Concentration de la bilirubine totale = Absorbance de la bilirubine
totale fois concentration de l'étalon / absorbance de l'étalon.
21 . Montrer qu'une concentration en bilirubine de 342 µmol / L est équivalente à 20 mg / dL.
M(blilrubine) =M(C33H36N4O6) =33 x12 +36 +14 x4+16 x6=584 g / mol.
342 10-6 x 584~0,2 g / L ou 0,02 g / dL ou 20 mg / dL.
22. Expliquer pourquoi si on dépasse 20 mg / dL il faut diluer l'échantillon.
La linéarité de la loi de Beer -Lambert n'est plus vérifiée au delà de 20 mg / dL.
23. Les mesures
réalisées sur l'échantillon d'un patient, avec un étalon ayant une
concentration en bilirubine de 5,2 mg / dL donnent :
Absorbance de l'échantillon : 0,062.
Absorbance de l'étallon : 0,180.
La concentration en bilitubine se situe -t-elle dans la plage [0,0 ; 1,5 mg / dL] ?
Concentration de la bilirubine totale = Absorbance de la bilirubine
totale fois concentration de l'étalon / absorbance de l'étalon.
Concentration de la bilirubine totale =0,062 / 0,180 x 5,2=1,8 mg / dL, donc en dehors de la plage normale.
|
|