Partie A - Dosage d’une solution d’acide lactique.
L’acide lactique est une molécule biosourcée produite à plus de 270 000
tonnes par an. Il possède un large éventail d’applications, notamment
dans l’agroalimentaire, les cosmétiques, l’industrie pharmaceutique et
l’emballage. La représentation développée de l’acide lactique est
donnée cidessous.
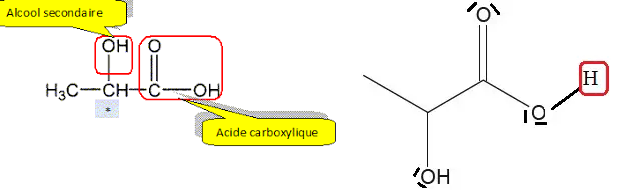
A.1. Représenter la
formule topologique de l’acide lactique, puis entourer les groupes
caractéristiques. Nommer les familles fonctionnelles de cette molécule.
Industriellement, l’acide lactique est principalement produit par fermentation bactérienne.
À l’issue de cette étape, on obtient une concentration en acide lactique comprise entre 53 g · L
−1et 85 g · L
−1.
On cherche dans cette partie à vérifier par titrage la concentration en
acide lactique dans une lotion utilisée en cosmétique, notée (S
0), dont la concentration de référence annoncée est de C
0,réf = 65 g · L
−1.
L’acide lactique sera noté A et sa base conjuguée A
−.
On prépare une solution (S
1) en diluant dix fois la solution (S
0).
Protocole du titrage :
• À l’aide d’une pipette jaugée, prélever 𝑉
1 = 20,00 mL de la solution (S
1), les verser dans un bécher de 100 mL et y introduire un barreau aimanté.
• Placer le bécher sur un dispositif d’agitation magnétique.
• Remplir une burette graduée de 25,00 mL d’une solution aqueuse d’hydroxyde de sodium (S
2) (Na
+(aq) + HO
−(aq)) de concentration 𝐶
2 = 1,00 × 10
−1 mol ∙ L
−1.
• Étalonner le 𝑝𝐻-mètre et immerger la sonde dans la solution à titrer.
• Effectuer le titrage de la solution (S
1) contenue dans l’erlenmeyer par la solution (S
2) contenue dans la burette graduée en suivant l’évolution du 𝑝𝐻.
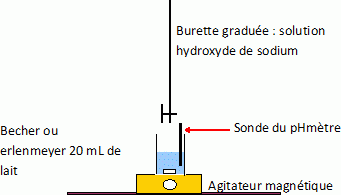
A.2. Schématiser et légender le dispositif expérimental utilisé pour réaliser le titrage.
 A.3.
A.3. Écrire l’équation de la réaction support du titrage.
AHaq + HO
-aq --> A
-aq + H
2O(l).
Les mesures du 𝑝𝐻 de la solution (S
1) en fonction du volume de la solution titrante (S
2) versé
conduisent à la courbe suivante.
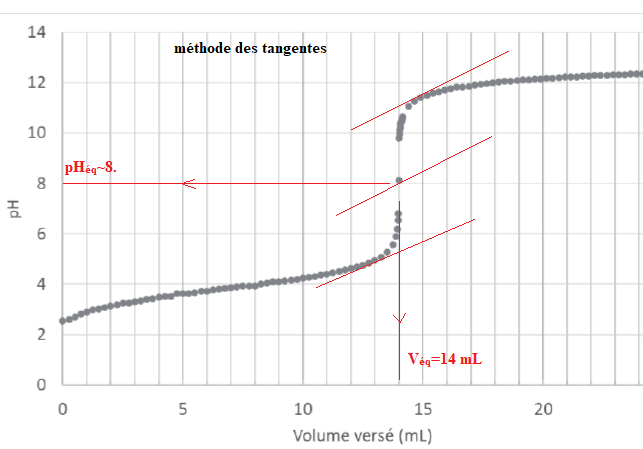
A.4.1. À partir de la courbe déterminer, en justifiant, le volume 𝑉
eq de solution titrante (S
2) versé à l’équivalence.
 A.4.2.
A.4.2. En déduire la concentration en quantité de matière 𝐶
0 en acide lactique dans la solution (S
0).
A l'équivalence : C
1 V
1 = C
2 V
éq ;
C1 = C2 Véq / V1 =0,100 x14 / 20 =0,070 mol / L.
C0 = 10 C1 = 0,70 mol / L.
A.4.3. Calculer l’incertitude-type 𝑢(𝐶0) associée à la mesure de la concentration en acide lactique dans la solution (S0).
u(C0) = C0 [(u(c2) / C2)2+(u(Véq) / Véq)2+(u(V1) / V1)2]½ =0,70 [(0,002 / 0,1)2+(0,25) / 14)2+(0,03) / 20)2]½ ~0,03 mol / L.
C0 = 0,70 ±0,03 mol / L.
M(acide lactique) =90,1 g / mol ; (0,70 ±0,03) x90,1 ~63 ±3 g / L.
C0 réf| =65 / 90,1 =0,72 mol / L.
A.4.4. Comparer le résultat de la mesure de la concentration 𝐶0 à la valeur de référence en calculant l’écart normalisé z. Conclure.
z = |C0-C0 réf| / u(C0)=(65-63) / 3 ~0,7 < 2, donc acord avec la valeur de référence.
A.5. Proposer, en justifiant, le nom d’un indicateur coloré permettant de repérer l’équivalence du titrage de l’acide lactique.
Le pH du point équivalent doit appartenir à la zone de virage de l'indicateur coloré, donc rouge de crésol.
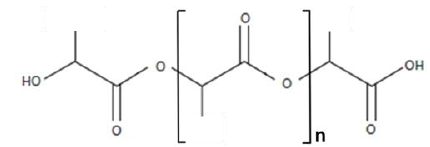
Partie B - Dégradation du PLA
L’acide polylactique (PLA) utilisé dans l’emballage est un polymère
biodégradable et biosourcé dont la formule chimique est donnée
ci-dessous.
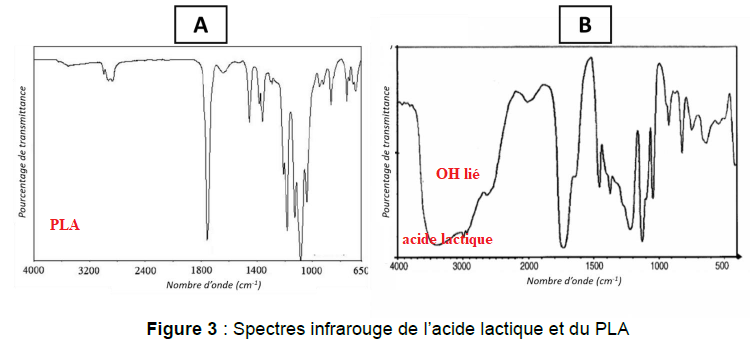
La spectroscopie infrarouge est une méthode d’analyse fréquemment
utilisée pour l’étude des polymères afin de déterminer, par exemple, la
présence d’impuretés.
B.1. Attribuer chacun des deux spectres infrarouge A et B à une espèce chimique (acide lactique et PLA). Justifier la réponse.