Optimisation
de la synthèse de l'éthanoate de benzyle,
bac général Amérique du Nord
2023.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
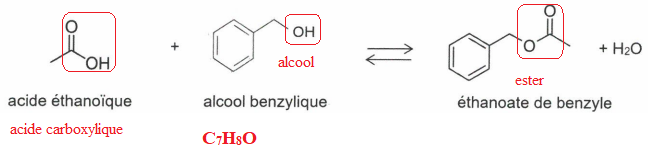
Formation de l'ester.
1. Donner la formule brute de l'alcool benzylique.
2. Entourer les groupes caractéristiques et nommer les familles fonctionnelles correspondantes.
3. Préciser laquelle des deux molécules suivantes est un isomère de l'alcool benzylique.
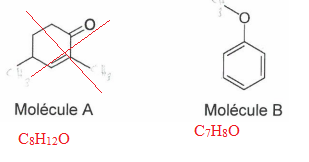
4. Cette synthèse étant lente, citer deux conditions expérimentales qui peuvent la rendre plus rapide.
Travailler à température plus élevée, la température étant un facteur cinétique.
Utiliser un catalyseur.
Optimisation du rendement.
protocole mis en oeuvre :
Dans un ballon sec, introduire V1 = 2,7 mL d'acide éthanoïque et V2 = 4,9 mL d'alcool benzylique.
Adapter un réfrigérant à eau au ballon et chauffer à ébullition pendant 25 min.
Quand le reflux cesse, ajouter dans le ballon 100 mL d'eau glacée.
Verser ce mélange réactionnel dans un becher de 250 mL et titrer l'acide éthanoïque restant.
5. Déterminer les quantités de matière initiales des réactifs.
acide éthanoïque : masse volumique 1,05 g / mL.
masse 1,05 x2,7 =2,835 g.
n = m / M(acide éthanoïque) = 2,835 / 60,0 =0,04725 ~0,047 mol.
alcool benzylique : masse volumique 1,04 g / mL
masse : 1,04 x 4,9 =5,096 g.
n =masse / masse molaire alcool benzylique = 5,096 / 108 =0,04719~0,047 mol.
6. Etablir la relation entre la quantité de matière d'acide éthanoïque consommé et la quantité de matière d'ester formé.
nester = n acide consommé.
Equation de la réaction support du titrage : CH3COOH aq + HO-aq --> CH3COO-aq + H2O(l).
On trouve Véq = 8,5 mL.
7. Déterminer la quantité de matière d'acide restant dans le mélange ( cB = 2,0 mol / L).
nacide restant = Véq CB =8,5 x2,0 =17 mmol = 1,7 10-2 mol.
8. Définir et calculer le rendement.
rendement =n ester réelle / n est théorique .
n ester réelle = nacide initial-n acide restant =0,04725 - 0,017 ~0,030 mol.
Rendement = 0,030 / 0,047 ~0,64 ( 64 %).
Dans les mêmes conditions expérimentales que le protocole 1 mais en
modifiant le volume d'acide éthanoïque V = 4 mL), on obtient un
rendement de 71 %.
9. Justifier l'évolution du rendement.
En introduisant un réactif en excès, on déplace l'équilibre dans le sens direct.
|