L’objectif de cet exercice est de comparer plusieurs protocoles permettant de
synthétiser au laboratoire cette espèce chimique, afin de déterminer quelle synthèse
est la plus éco-responsable.
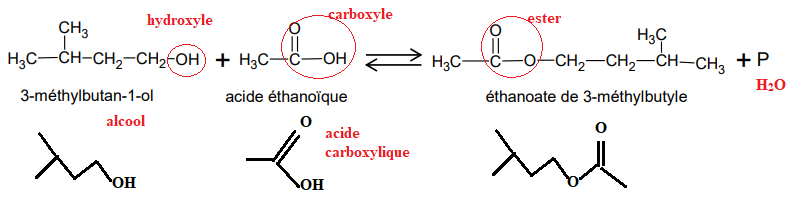
L’équation de la réaction de synthèse de l’éthanoate de 3-méthylbutyle est la suivante :
1. Identification des espèces mises en jeu dans la réaction
Q1. Représenter la formule topologique des réactifs et de l’éthanoate de 3-méthylbutyle. Entourer les groupes
caractéristiques et identifier les familles fonctionnelles correspondantes.
 Q2.
Q2. Justifier que le produit P obtenu lors de cette synthèse est de l’eau.
Acide carboxylique + alcool = ester + eau.
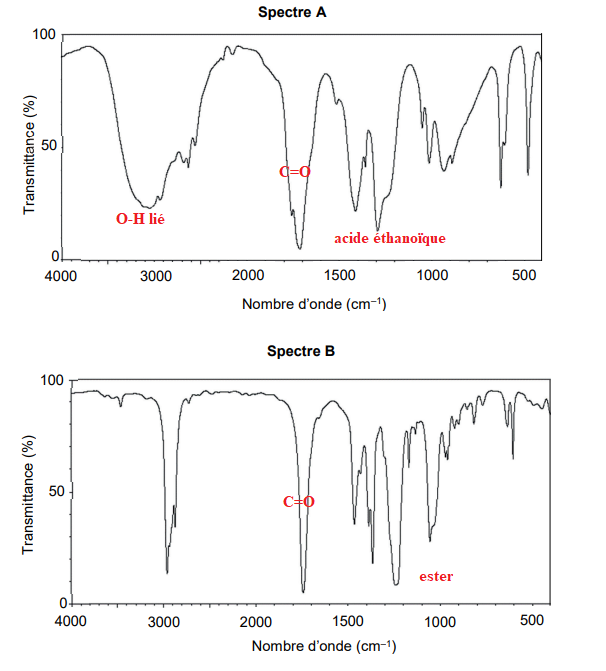
Q3. Attribuer, à l’aide des données et en justifiant, chacun des spectres A et B représentés ci-après soit à
l’acide éthanoïque, soit à l’éthanoate de 3-méthylbutyle.
 2. Comparaison de protocoles de synthèse
2. Comparaison de protocoles de synthèse.
Protocole A : synthèse avec montage de chauffage à reflux
- Étape 1 : dans un ballon on introduit 22 mL de 3-méthylbutan-1-ol, 15 mL d’acide éthanoïque pur et
10 gouttes d’acide sulfurique concentré, ainsi que quelques grains de pierre ponce.
- Étape 2 : le mélange est chauffé à reflux pendant 45 minutes puis refroidi à la température
ambiante.
- Étape 3 : la phase organique est ensuite lavée avec une solution aqueuse saturée de chlorure de
sodium puis avec une solution aqueuse d’hydrogénocarbonate de sodium. La phase organique est
alors séchée à l’aide de sulfate de magnésium anhydre.
- La masse d’éthanoate de 3-méthylbutyle obtenue est m
B = 19,7 g.
Q4. Nommer les étapes 2 et 3 du protocole A.
Etape 2 : synthèse de l'ester.
Etape 3 : purification du produit, l'ester.
L’acide sulfurique concentré est utilisé comme catalyseur dans ce protocole.
Q5. Préciser le sens du mot catalyseur.
Un catalyseur accélère une réaction thermodynamiquement possible sans modifier la composition à l'équilibre.
Le catalyseur intervent dans une première étape et se trouve régénéré
lors de la dernière étape. Il n'apparaît pas dans le bilan.
Q6. Préciser l’utilité du montage de chauffage à reflux dans ce protocole.
La température est un facteur cinétique. Le chauffaage à reflux
accélère la réaction et évite les pertes de matière : les vapeurs se
condensent dans le réfrigérant et retombent dans le milieu
réactionnel.
Lors du second lavage de l’étape 3 du protocole, on observe un dégagement gazeux.
Q7. Proposer une explication à cette observation et justifier l’utilité de cette étape.
Elimination des acides. l'ion hydrogénocarbonate est une base.
H
3O
+aq + HCO
3-aq --> CO
2(g) + 2H
2O(l).
Q8. Déterminer le réactif limitant utilisé dans le protocole A puis calculer le rendement de la synthèse réalisée
en suivant ce protocole.
Alcool : V = 22 mL ; masse volumique 0,81 g / mL ; masse m = 22 x0,81 =17,8 g.
M(alcool) = 88,2 g / mol ; n = m / M = 17,8 / 88,1 =0,202 mol.
Acide éthanoïque : 15 mL ; densité d =1,05 ; m = 15 x1,05 =15,75 g.
M(acide éthanoïque) = 60 g / mol ; n = 15,75 / 60 =0,263 mol.
0,202 mol d'alcoll réagit avec 0,202 mol d'acide éthanoïque ; ce dernier est donc en excès.
Quantité théorique d'ester ( si réaction totale) : 0,202 mol.
M(ester) =130,2 g / mol : m
théorique(ester) =0,202 x130,2 =26,3 g.
Rendement = masse réelle / masse théorique = 19,7 / 26,3 =0,75.