Préparation
du chlorure de tertiobutyle,
bac général Centre étrangers
2023.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| .. |
.
.
|
|
.
.
|
..
..
......
...
|
Les halogénoalcanes sont des espèces chimiques très réactives et très utilisées comme agents de
synthèse. Les halogénoalcanes existants peu à l’état naturel, la grande majorité doit être
synthétisée.
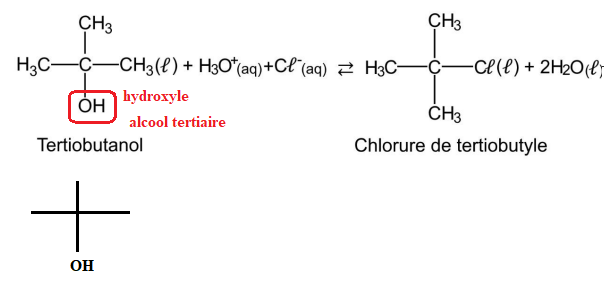
On s’intéresse à la préparation du chlorure de tertiobutyle (ou 2-chloro-2-méthylpropane) à partir du
tertiobutanol (ou 2-méthylpropan-2-ol).
En effet, le tertiobutanol réagit avec de l’acide chlorhydrique pour former le chlorure de tertiobutyle
et de l’eau selon la réaction d’équation.
Q.1. Représenter la formule topologique du tertiobutanol. Entourer le groupe caractéristique et
nommer la famille fonctionnelle correspondante.
À partir d’acide chlorhydrique commercial concentré à 37 % en masse, ( densité 1,19) on prépare un volume
V = 250,0 mL d’une solution d’acide chlorhydrique S à la concentration C = 2,4 mol·L-1
.
Q.2. Présenter la démarche à mettre en œuvre pour préparer la solution S, en indiquant la
verrerie utilisée.
Masse d'acide dans un litre : 1,19 x 0,37 =0,4403 kg = 440,3 g.
Concentration : 440,3 / (MHCl) = 440,3 / 36,5 =12 mol / L.
Fcteur de dilution : 12 / 2,4 = 5.
Fiole jaugée de 250,0 mL contenant 1/3 d'eau distillée.
Prélever à la pipette jaugée 250 /5 =50,0 mL de solution commerciale.
Compléter avec de l'eau distillée jusqu'au trait de jauge.
Boucher et agiter pour rendre homogène.
Protocole de synthèse du chlorure de tertiobutyle à partir du tertiobutanol :
Étape 1 : dans un erlenmeyer de 250 mL, introduire successivement une masse mA = 5,00 g de
tertiobutanol, préalablement fondu au bain-marie et un volume V = 100 mL d’acide chlorhydrique S
à une concentration C = 2,4 mol·L-1, réactif en excès. Boucher et porter sous agitation magnétique
pendant 10 minutes.
Étape 2 : introduire le mélange dans une ampoule à décanter. Effectuer un premier lavage en
introduisant, dans l’ampoule à décanter, 150 mL d’une solution aqueuse d’hydrogénocarbonate de
sodium Na+
(aq) + HCO3
−
(aq). Agiter en dégazant le contenu de l’ampoule, laisser décanter et
séparer la phase aqueuse. Effectuer un second lavage de la phase organique en ajoutant 25 mL
d’eau déminéralisée. Agiter, laisser décanter et recueillir la phase organique dans un erlenmeyer
bien sec.
Étape 3 : sécher la phase organique avec du chlorure de calcium anhydre. Filtrer et récupérer le
filtrat dans un ballon de 100 mL. Effectuer une distillation afin de recueillir le chlorure de tertiobutyle
pur.
Étape 4 : identifier le chlorure de tertiobutyle obtenu par spectroscopie infra-rouge.
Le premier lavage, à l’aide de la solution aqueuse d’hydrogénocarbonate de sodium, permet
d’éliminer les ions oxonium.
Q.3. Écrire l’équation de la réaction acide-base qui modélise la transformation chimique ayant
lieu dans l’ampoule à décanter (étape 2) et préciser le nom du gaz formé.
HCO3
−
(aq) + H3O+aq -->CO2 (g) + 2H2O(l)
Dioxyde de carbone.
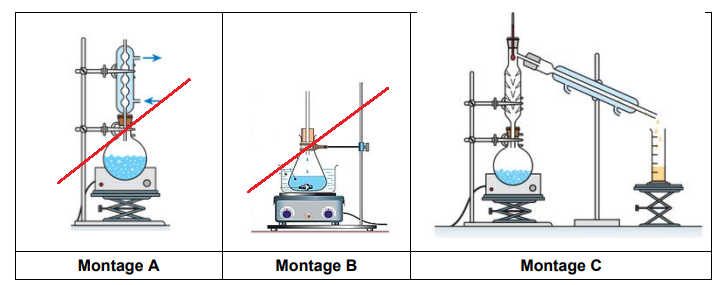
Q.4. Parmi les montages ci-après, indiquer celui utilisé pour purifier le chlorure de tertiobutyle
par distillation.
|
...
|
....
|
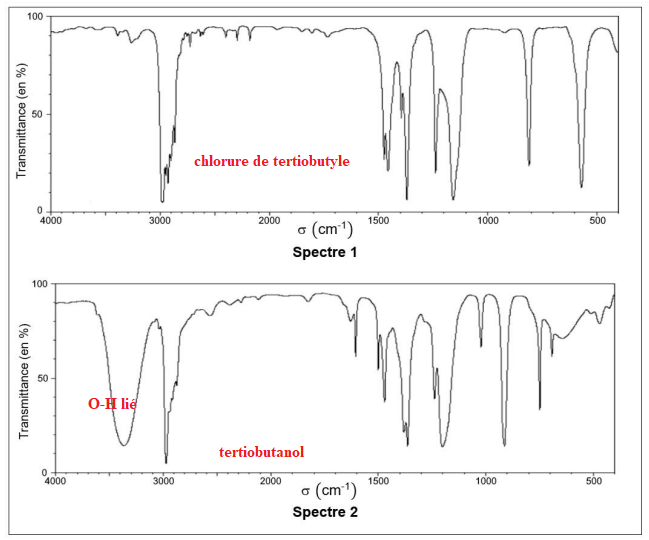
Q.5. La figure suivante fournit les spectres IR du tertiobutanol et du chlorure de tertiobutyle. Attribuer
chaque spectre à une espèce chimique en explicitant le raisonnement.
Q.6. À l’issue de la distillation, on recueille une masse m = 4,45 g de chlorure de tertiobutyle.
Déterminer la valeur du rendement de la synthèse.
Quantité de matière théorique de tertiobutyle :
mA = 5,00 g de
tertiobutanol, M =74 g / mol.
n = 5,0 / 74 =0,0676 mol.
Quantité de matière de tertiobutyle : 0,0676 mol ; M =92,5 g / mol.
masse = 0,0676 x92,5 = 6,25 g.
Rendement = masse réelle / masse théorique = 4,45 / 6,25 =0,71 ( 71 %).
|
|