Synthèse
et recyclage du PET en vanilline,
bac général Centre étrangers
2023.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
Le polytéréphtalate d’éthylène (PET) est
également connu sous de nombreux autres noms comme
Dacron (USA) ou tergal (France). Il fait partie de la famille des
polyesters.
Le PET est surtout utilisé pour la production de fibres synthétiques et
pour la production de bouteilles
en plastique.
Plusieurs méthodes permettent aujourd’hui de le recycler.
Cet exercice comporte deux parties. Dans la première partie, nous
étudierons la synthèse du
polytéréphtalate d’éthylène (PET) puis dans la deuxième partie, nous
verrons l’une des voies de
recyclage du PET, la voie microbienne.
A. Synthèse du PET
L’une des voies de synthèse utilise la transformation chimique prenant place entre l’acide
téréphtalique et l’éthylène glycol. En nomenclature officielle l’éthylène glycol se nomme
éthan-1,2-diol.
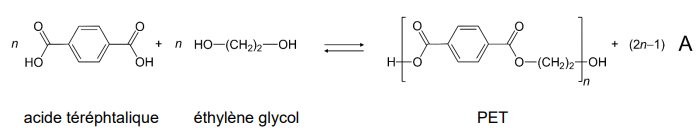
L’équation de la réaction modélisant la transformation chimique entre l’acide téréphtalique et
l’éthylène glycol conduisant au PET et à l’espèce chimique notée A, est la suivante :
Le protocole expérimental de synthèse du PET est le suivant :
Étape 1 : on introduit dans un ballon 20,0 g d’acide téréphtalique et 40 mL d’éthylène glycol, puis le
mélange est porté à reflux sous vide pendant 5 h. Le produit A est éliminé au cours de la
transformation.
Le milieu réactionnel obtenu à l’issue de la transformation est visqueux et de couleur
brune grisâtre.
Étape 2 : ce milieu réactionnel contenant le PET est traité par plusieurs lavages successifs à
l’éthanol et au pentane.
Étape 3 : ce milieu réactionnel est ensuite séché puis analysé par chromatographie et par
spectrométrie infrarouge (IR).
Q.1. Indiquer les précautions à prendre pour la manipulation des réactifs.
Les réactifs étant nocif, irritant des voies respiratoire,
inflammables, travailler sous hotte aspirante, port de blouse, gant et
lunette, loin de toute flamme.
Q.2. Identifier la molécule A formée lors de l’étape 1. Préciser sa formule chimique et son nom.
H2O eau.
Q.3. Expliquer l’intérêt d’éliminer la molécule A au cours de l’étape 1.
En éliminant l'un des produits au fur et à mesure de sa formation, on déplace l'équilibre dans le sens direct.
Q.4. Nommer les étapes 1, 2 et 3 du protocole expérimental.
Etape 1 : synthèse
Etape 2 : purification.
Etape 3 : identification du produit.
La formule chimique du PET est la suivante.
Q.5. Expliquer pourquoi le PET appartient à la famille des polyesters.
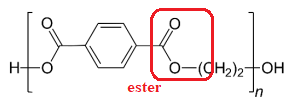
Q.6. Identifier le motif du PET.
Le motif du PET se trouve entre les crochets.
L’analyse du PET synthétisé permet d’évaluer sa masse molaire moyenne à 3 600 g.mol-1
.
Q.7. Sachant que la masse molaire du motif Mmotif du polymère est de 192 g.mol-1, estimer la
valeur de n.
3600 / 192 ~ 19 motifs.
Une bouteille en plastique est constituée, en moyenne, de 32 g de PET.
Q.8. Déterminer, en justifiant, si la synthèse réalisée permet de fabriquer une bouteille en
plastique.
40 mL d’éthylène glycol, masse volumique 1,1 g / mL ; M =62,07 g / mol.
n =40 x1,1 / 62,07 =0,709 mol.
20,0 g d’acide téréphtalique M = 166,14 g / mol. ; n = 20,0 / 166,14 =0,120 mol.
0,12 mol de cet acide réagit avec 0,12 mol d'éthylène glycol, ce dernier est en excès.
On peut obtenir au mieux 0,12 mol de PET soit 0,12 x 192 =23 g.
C'est insuffisant pour fabriquer la bouteille.
|
...
|
....
|
B. Synthèse microbienne de la vanilline à partir de déchets de PET
Une équipe de chercheur de l’Université d’Edimbourg a publié un article dans la revue « Green
Chemistry, 2021, 23, 4665 » dans lequel elle explique comment elle a développé un premier
recyclage biologique de déchets plastiques de PET en vanilline à l’aide d’un micro-organisme
modifié.
Le polymère est dans un premier temps hydrolysé en deux monomères, l’acide téréphtalique et
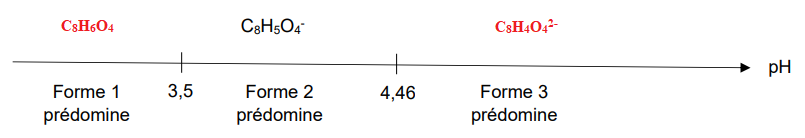
l’éthylène glycol. L’acide téréphtalique est un diacide que l’on peut noter AH2 dont les deux pKa sont
pKa1 = 3,5 et pKa2 = 4,46.
Q.9. Donner la définition d’un acide selon Bronsted.
Un acide est une espèce susceptible de céder un proton H+.
Les domaines de prédominance de l’acide téréphtalique sont donnés sur le diagramme suivant.
Q.10. Indiquer les formules brutes des formes 1 et 3 présentes sur le diagramme précédent.
Les chercheurs ont étudié comment maximiser le rendement en vanilline lors du recyclage du PET.
Ils ont observé que les micro-organismes permettant d’obtenir la vanilline ne peuvent pas jouer leur
rôle efficacement en présence d’une forme acide de l’acide téréphtalique. De plus, ils ont remarqué
expérimentalement qu’en milieu trop fortement basique la transformation est limitée. Ils ont établi
expérimentalement qu’une solution tampon à pH = 5,5 permet d’arriver à leur fin.
Q.11. Montrer que le choix d’une solution tampon à pH = 5,5 respecte les conditions
expérimentales souhaitées.
A pH = 5,5, le milieu est acide et la forme 3 est majoritaire ; de plus ce n'est pas une des formes acides de cet acide.
|
|