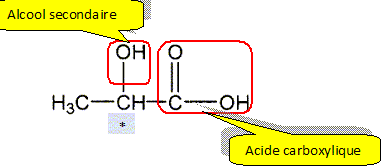
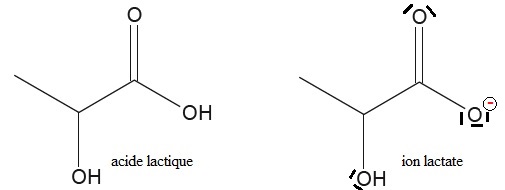
A Dosage spectrophotométrique des ions nitrate dans une eau.
Par
ajout d'acide 2,4-phénoldisulfonique, une solution acqueuse incolore
prend une teinte jaune plus ou moins prrononcée suivant la
concentration en ion nitrate. La concentration en ion nitrate de cette
solution peut alors être déterminée par la mesure de son absorbance à
une longueur d'onde donnée.
Etape 1 : obtention d'une courbe d'étalonnage.
On prélève V = 250 mL d'eau étudiée que l'on fait réagir avec un excès d'acide 2,4-phénoldisulfonique.
On mesure l'absorbance de cette solution avec les mêmes réglages que
ceux utilisés à l'étape 1. l'absorbance mesurée vaut A = 0,48.
1. Indiquer la longueur d'onde la plus appropriées pour réaliser ce dosage.
La solution étant jaune, elle présente un maximum d'absorption dans le bleu ( 440 nm).
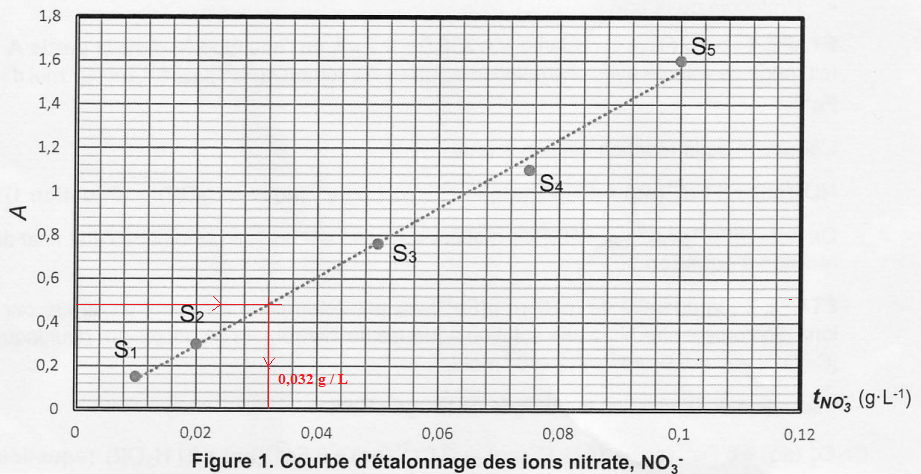
2. Déterminer la concentration en masse d'ion nitrate de cette eau.
Le graphe donne t1 = 0,032 g / L.
3. Ecrire le résultat de la mesure de cette concentration sachant que u(t1) / t1 est de l'ordre de 15 %.
u(t1) = 0,15 t1 = 0,15 x0,032 ~0,005 g / L.
t1 = 0,032 ±0,005 g / L.
B. Dosage conductimétrique des ions nitrate dans cette eau.
On fait réagir les ions nitrate avec une quantité connue d'ion fer (II) en excès et en milieu acide ( étape 1).
On prélève V = 250,0 ±0,2 mL d'eau étudiée. On fait réagir ce volume avec une solution acidifiée contenant n(Fe2+)total = 4,0 10-3 mol d'ions Fe2+.
NO3-aq + 3 Fe2+aq + 4H3O+aq --> NO(g) + 3Fe3+aq +6 H2O(l) (1).
L'excès d'ion fer (II) est titré par conductimétrie ( étape 2) par les ions dichromate de concentration C = 5,0 10-2 ±0,2 10-2 mol / L.
Cr2O72-aq +6Fe2+aq +14H3O+aq -->2 Cr3+aq +6Fe3+aq +21 H2O(l) (2).
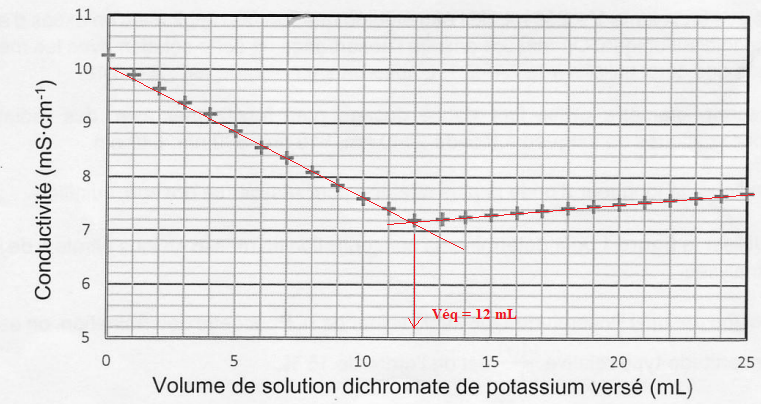
4. Identifier le réactif titré et le réactif titrant ( étape 2).
Fe2+ : réactif titré ; ion dichromate : réactif titrant.
5. Montrer que n(Fe2+)excès = 3,6 mmol.
n(dichromate )= C Véq =5,0 10-2 x12 =0,60 mmol.
n(Fe2+)excès =6 n(dichromate )=6 x0,6 = 3,6 mmol.
6. Justifier que n(nitrate) = (n(Fe2+)totale -n(Fe2+)excès) / 3.
n(Fe2+) réagissant à l'étape 1 : n = n(Fe2+)totale -n(Fe2+)excès.
n(nitrate) = n / 3.
7. En déduire que la concentration d'ion nitrate vaut t2 = 33 mg / L.
n =4,0 10-3 -3,6 10-3 = 4,0 10-4 mol.
n(nitrate) =4,0 10-4 / 3 =1,33 10-4 mol ; [nitrate] =1,33 10-4 / 0,250 =5,33 10-4 mol/ L
M(nitrate )= 63 g / mol ; t2 = 63 x5,33 10-4 =3,36 10-2 g / L ~ 33 mg / L.
8. Calculer u(t2) sachant que u(Véq) = 0,5 mL.
u(t2) = t2 x [(u(C) / C)2+(u(Véq) / Véq)2+(u(V) / V)2]½ =33 x [(0,2) / 5)2+(0,5 / 12)2+(0,2 / 250)2]½ ~ 2 mg / L.
31 < t2 < 35 mg / L.
Cette valeur étant inférieure à 50 mg/ L, cette eau peut être utilisée pour fabriquer les biberons.