Vérification du degré d'un vinaigre blanc.
Ce vinaigre est une solution aqueuse à 8 % d'acide éthanoïque. Son ph est d'environ 3.
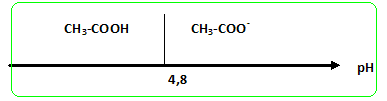
1. Tracer le diagramme de prédominance du couple acide éthanoïque / ion éthanoate pKa = 4,8.
On réalise un titrage avec suivi pHmétrique d'un volume V
1 = 5,0 mL de vinaigre avec une solution de soude de concentration C
b = 0,50 mol / L. V
éq = 13,4 mL.
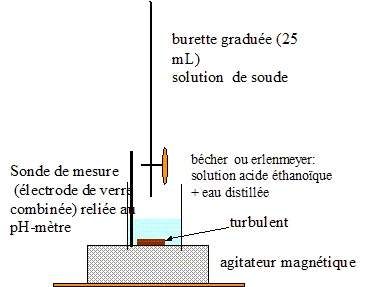
2. Faire un schéma annoté du montage.
3. Ecrire la réaction support du titrage.
HO- aq+
CH3COOHaq = H2O +
CH3COO-aq.
4. Déterminer la concentration Ca de cet acide dans le vinaigre.
A l'équivalence Ca V1 = Cb Véq ; Ca =0,50 x 13,4 / 5,0=1,34 ~1,3 mol / L.
5. Vérifier que le titre du vinaigre est bien 8 °.
Masse d'acide éthanoïque dans 1 L de vinaigre.
1,34 M(CH3COOH) = 1,34 x 60=80,4 g / L.
Masse volumique du vinaigre 1010 g / L.
Masse de 1 L de vinaigre : 1010 g.
80,4 g d'acide éthanoïque dans 1010 g soit 80,4 /1010 x100 ~ 8 g d'acide éthanoïque dans 100 g de vinaigre ( 8 degrés ).