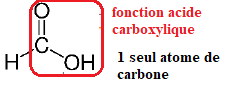L'acide
formique pour stocker de l'hydrogène, bac Asie 2022.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
Partie A - Intérêt de l’acide formique pour
le stockage du dihydrogène
L’objectif de cette partie A est d’étudier l’intérêt de l’acide
formique pour le stockage du dihydrogène par rapport au stockage du gaz
sous pression.
1. La formule
semi-développée de l’acide formique est donnée ci-contre.
Justifier que cet acide se nomme acide méthanoïque dans la nomenclature
officielle.
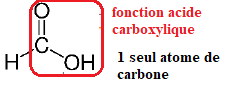
2. Vérifier
qu’un litre de dihydrogène à la pression 𝑃=350 bar et à la
température de 25 °C contient une masse m=28 g de dihydrogène. On
supposera que ce gaz obéit à l’équation des gaz parfaits dans ces
conditions de température et de pression.
PV = n RT ; n = PV / (RT) = 350 105 x1 10-3) /
(8,3 x298) =14,15 mol.
Masse : 14,15 M(H2) = 14,15 x2 ~28 g.
Pour récupérer le dihydrogène à partir de l’acide formique, on réalise
une transformation dont l’équation de réaction est : HCOOH (l) -->H2(g)+CO2(g)
Cette transformation est considérée comme totale.
3. Vérifier qu’un
litre d’acide formique permet de produire 53 g de
dihydrogène.
Masse volumique de l'acide formique : 1,22 kg / L. M(HCOOH) =46 g
/ mol.
Masse de 1 L d'acide formique : 1,22 kg ; quantité de matière n = 1,22
103 / 46 =26,5 mol.
Masse d'hydrogène m = n M(H2) =26,5 x2 =53 g.
4. Citer deux
avantages de l’acide formique pour le stockage du
dihydrogène par rapport au stockage du gaz sous pression.
Evite des contenants capable de supporter de fortes pressions.
L'acide formique est très peu inflammable et liquide à température
ambiante.
|
...
|
....
|
Partie
B – Contrôle de la teneur en acide formique d’une solution aqueuse
d’acide formique
On met en oeuvre une méthode conductimétrique pour contrôler rapidement
la teneur en acide formique d’une solution aqueuse d’acide formique
préparée par les chercheurs de l’université de Rice.
À cet effet :
On dilue 100 fois la solution aqueuse S0 d’acide formique
préparée par les chercheurs. On obtient une solution fille S1
de concentration 𝐶1.
On prélève un volume 𝑉1=1,00 L de cette solution S1.
On réalise une mesure de la conductivité de la solution S1.
L’équation de la réaction acido-basique de l’acide formique avec l’eau
est :
HCOOH(aq)+H2O =HCOO−(aq)+H3O+(aq)
(réaction 1)
En vue de relier la conductivité à la concentration, on fait les
hypothèses suivantes :
On néglige l’effet de l’autoprotolyse de l’eau.
On suppose que les seules espèces contribuant significativement à la
conductivité de la solution sont les ions oxonium, H3O+,
et les ions formiate, HCOO−.
5. Exprimer la
conductivité s de
la solution en fonction des concentrations et des conductivités
molaires ioniques des ions oxonium et des ions formiate.
s = l(H3O+) [H3O+] + l(HCOO−) [HCOO−] .
6. En déduire une relation entre 𝜎, l(H3O+), l(HCOO−), 𝑉1 et l’avancement
xf en fin de réaction pour la réaction 1 (xf en
mol).
[H3O+] = [HCOO−] =xf / V1.
s =( l(H3O+) + l(HCOO−) )xf / V1.
La mesure de la
conductivité de la solution S1 donne 144 mS·m−1
.
7. Montrer que
l’avancement en fin de réaction a pour valeur : xf=3,56×10−3
mol.
144 =(35,0 +5,46) )xf / (1 10-3)
; xf =144 10-3/
40,46=3,56×10−3
mol.
On admet que la
constante d’équilibre Ka peut s’écrire en fonction de l’avancement en
fin de réaction xf sous la forme approchée :
Ka=(xf / V1)2×1 /(c0×C1)
8. Déterminer la
valeur de la concentration molaire 𝐶1 de la solution S1
. Ka = 1,77 10-4.
1,77 10-4 =(3,56×10−3)2 / C1 ; C1 =7,2 10-2 mol / L.
9. En déduire la concentration molaire 𝐶0 de la solution 𝑆0.
Comparer qualitativement la concentration obtenue à la teneur en acide
formique annoncée dans l’article du document 2 ( 7,0 mol / L).
C0 = 100 C1 =7,2 mol / L.
Ecart relatif (7,2-7) / 7 ~ 3 %. Les deux résultats sont en accord.
|
|