Chimie
générale, concours TSPEI 2021.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
.
.
|
..
..
......
...
|
Les molécules.
I. Structures moléculaires.
Soit l'azote 147N. Combien
l'atome comporte-t-il d'électrons ? De neutrons ?
Identifier ces plus proches voisins. Donner sa structure électronique
et son schéma de Lewis.
7 électrons ; 7 protons et 14-7= 7 neutrons.
Ces plus proches voisins sont le carbone et l'oxygène.
Structure électronique : 1 s2 2s2 2p3.
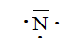
Soit
l'azote 126C. Combien l'atome comporte-t-il
d'électrons ? De neutrons ?
Identifier ces plus proches voisins. Donner sa structure électronique
et son schéma de Lewis.
6 électrons ; 6 protons et 12-6= 6 neutrons.
Ces plus proches voisins sont le bore et l'azote.
Structure électronique : 1 s2 2s2 2p2.
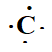
Donner les structures du dioxyde de carbone et d'ammoniac. Justifier.
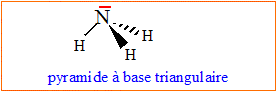 L'atome
d'azote central est du type AX3E. L'atome
d'azote central est du type AX3E.
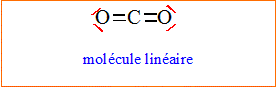 L'atome
de
carbone central est du type AX2.
2. Calcul
d'incertitude. L'atome
de
carbone central est du type AX2.
2. Calcul
d'incertitude.
On étudie la balance à poids mort pour étalonner un capteur de pression
à membrane affleurant avec jauge de contrainte à 60°C.
Pour cette balance 100 g est équivalent à 1 bar.
m : masse du poids posé sur la balance ; Péqui : pression
équivalente à la masse.
masse
(g)
|
1000
|
600
|
1000
|
2500
|
3500
|
5500
|
7500
|
9000
|
7000
|
5000
|
3000
|
200
|
0
|
Péqui(bar)
|
10,00
|
6,00
|
10,00
|
25,00
|
35,00
|
55,00
|
75,00
|
90,00
|
70,00
|
50,00
|
30,00
|
2,00
|
0
|
Patm
(mbar)
|
995,98
|
995,75
|
995,79
|
995,82
|
995,83
|
995,74
|
995,76
|
995,72
|
995,68
|
995,7
|
995,71
|
995,68
|
995,78
|
P=Patm
+ Péqui bar
|
10,99
|
6,99
|
10,99
|
25,99
|
35,99
|
55,99
|
75,99
|
90,99
|
70,99
|
50,99
|
30,99
|
2,99
|
0,995
|
Plue
(bar)
|
10,48
|
6,46
|
10,49
|
25,58
|
35,63
|
55,74
|
75,82
|
90,89
|
70,82
|
50,73
|
30,62
|
2,44
|
0,42
|
P-Plue
|
0,51
|
0,53
|
0,50
|
0,41
|
0,36
|
0,25
|
0.17
|
0,10
|
0,17
|
0,26
|
0,37
|
0,55
|
0,575
|
Valeur moyenne P-Plue = 0,36.
On choisit P = AP2lue + B Plue + C.
Identifier les coefficients.
A ~ 0 ; B ~1 ; C ~0,36
En
déduire la précision du capteur de pression et son incertitude de type
B.
II. Le dioxyde de carbone.
A. Solubilité dans l'eau.
1. Rappeler ce
qu'est un fluide supercritique.
Un fluide supercritique est un fluide chauffé au-delà des sa
température critique et comprimé au-dessus de sa pression critique. Les
propriétés physique de ce fluide sont intermédiaires entre celles d'un
liquide et celles d'un gaz.
On considère le système CO2 eau.
L'équation suivante donne l'expression de la valeur de la constante de
la loi de Henry.
ln H = ln Psat eau -9,4234 / Tr
+4,0087(1-Tr)0,355 / Tr +10,3199(1-Tr)Tr-0,41.
Tr = T / Tc eau = T / (647,14+273) = T / 920,14.
Unité de la constante de Henry : MPa.
Tension de vapeur de l'eau : ln Psat eau
= 73,649 -7258,2 / T-7,33037 lnT +4,1653 10-6 T2.
T en kelvin et P en bar.
1.1. Rappeler la
définition de la loi de Henry.
A température constante et à saturation, la quantité de gaz dissout
dans un liquide est proportionnelle à la pression partielle qu'exerce
le gaz sur ce liquide.
1.2. Déterminer la
solubilité du CO2 dans l'eau à 5°C, 10°C, 25°C, 50°C, 100°C
et 250C. Pression partielle en CO2 = 5 MPa. Qu'en déduire ?
Température
T (K)
|
278
|
283
|
298
|
323
|
373
|
523
|
ln Psat eau
|
6,76
|
7,10
|
8,05
|
9,41
|
11,5
|
15,2
|
Tr(K)
|
0,3021
|
0,3075
|
0,3239
|
0,3510
|
0,4054
|
0,5684
|
ln(H)
en MPa
|
21,1
|
21,35 |
21,94 |
22,7 |
23,6 |
23,88 |
Fraction
molaire CO2, notée x
|
5
/ 21,1 ~0,237
|
0,234 |
0,228 |
0,220 |
0,212
|
0,209
|
Solubilité
mol / L : 55,6 x /(1-x)
|
17,2
|
17,0
|
16,4
|
15,7
|
15
|
14,7
|
Dans 1 L d'eau (1000 g) il y a environ
1000 / 18 ~55,6 moles d'eau.
n : nombre de moles de CO2 dans 1 L d'eau.
x = n / (55,6+n).
La solubilité du CO2 diminue quand la température augmente.
2. Le CO2
peut réagir avec l'eau.
CO2 dissout+ 2H2O(l)
--> H3O+aq +HCO3-aq.
pKa = 6,4 à 25°C.
Calcul du pH de concentration c = 0,1 mol/L en CO2.
Ka = [H3O+aq][HCO3-aq] / [CO2 dissout] ~ [H3O+aq]2
/ c.
[H3O+aq]2
= Ka c ; 2 log [H3O+aq] =log Ka +
log c.
pH = ½pKa -½c =3,2+0,5=3,7.
CO2 dissout est essentiellement
sous forme HCO3-aq. Le milieu
est acide et peut provoquer une
dissolution importante de certains minéraux de la roche.
3.
Les aquifères salins contiennent des sels. De manière qualitative,
expliquer pourquoi la solubilité du CO2 est plus faible.
En présence de
sels en concentration suffisante, la force ionique de la solution
augmente notablement.
B. Un projet original de
stockage du CO2.
Immersion des blocs de CO2 solide dans les fosses marines de
grandes profondeurs.
1. Compléter le
diagramme des phases.
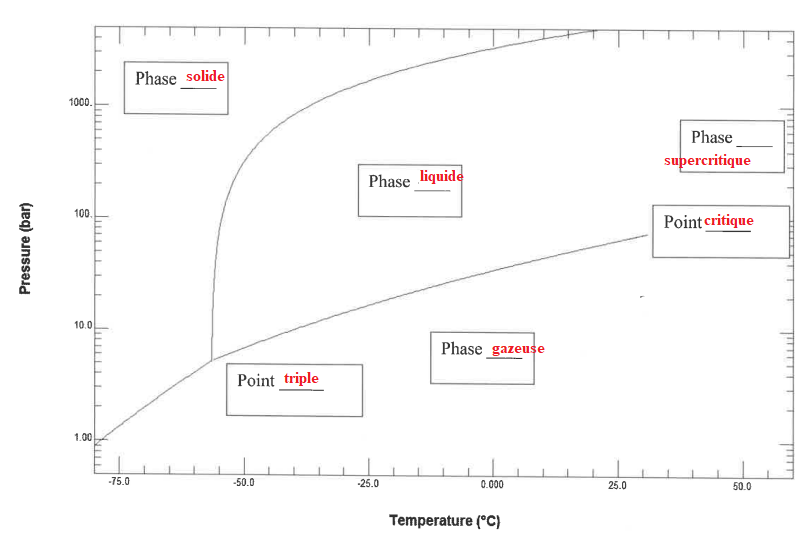
2. La température
moyenne de l'océan est de 10°C. A la surface de l'océan la pression est
de 1 bar. Sous quelle forme devrait être le CO2 ? En
considérant que le CO2 est sous forme de bloc solide, quelle
est la transition d'état qui est susceptible de se produire ?
Sous une pression de 1 bar à 10°C le dioxyde de carbone est sous forme
de gaz.
La transition solide --> gaz ( sublimation ) peut alors se produire.
3. Lorsque le bloc
est immergé, la statique des fluides s'applique. Montrer que dP / dz = reau g et en
déduire l'évolution de la pression en fonction de la profondeur. reau mer
=1020 kg /m3.
La
loi fondamentale de la statique des fluides reliant la différence de
pression pA -
pB entre
deux points A et B d’un fluide incompressible à r,
g, et zB –
zA ,
s’écrit
pA -
pB = r.g.(zB –
zA)
; zA et
zB étant
les ordonnées des points A et B sur un axe des z orienté suivant la
verticale ascendant.
4. En
déduire la valeur de la profondeur minimale de la fosse marine pour que
le bloc reste stable. Conclure.
Dans les grandes profondeurs, la température de
l'eau est voisine de 2°C.
A cette température, le dioxyde de carbone est solide sous une pression
voisine de 1200 bar. ( voir graphe).
pA -
pB = r.g.(zB –
zA)
;
Masse volumique de l'eau de mer dans de grandes profondeurs : 1020
kg /m3.
Profondeur
minimale de la fosse : 1200 x 105 / (1050 x9,8) ~1,17 104
m ~11,7 km.
La fosse la plus profonde du monde atteint 11 km.
Il n'y a donc pas de fosses suffisamment profondes pour stocker du CO2
solide.
|
...
|
....
|
Chimie organique.
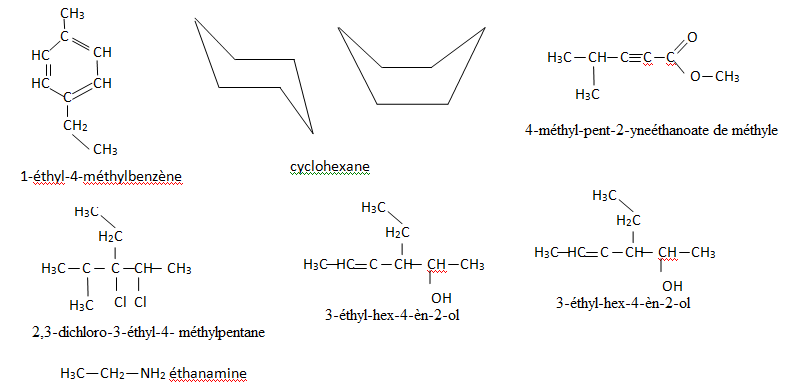
1. Donner les
formules semi-développées du :
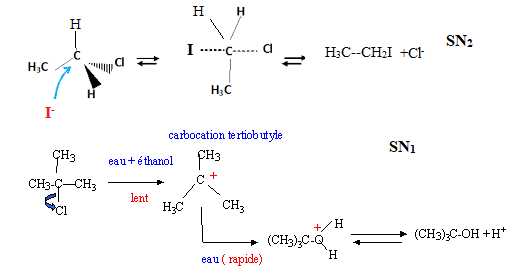
2. Rappeler les
principes généraux de la réaction de substitution nucléophile.
Expliquer le mécanisme de la réaction :
CH3-CH2-Cl + NaI --> CH3-CH2-I
+NaCl.
C'est
une réaction au cours de laquelle un groupe nucléophile riche en
électrons attaque une molécule électrophile ( possédant un site pauvre
en électrons) et remplace un atome ou un groupe d'atomes.
Thermochimie. Synthèse de l'ammoniac.
La synthèse est une transformation limitée dont l'équilibre chimique a pour équation :
N2(g) + 3H2(g) = 2NH3(g).
1. Déterminer la valeur de la constante d'équilibre Kp à 25°C.
DrG° = 2 DfG°(NH3) - 3 DfG°(H2) - DfG°(N2) = 2(-16,4 ) = -32,8 kJ mol-1.
DrG° = -RT ln K ; lnK = 32,8 103 / (8,314 x298) =13,24.
Kp =5,6 105.
2. En supposant que
les capacités calorofiques ne dépendent pas de la température,
déterminer l'expression de l'enthalpie de réaction en fonction de la
température. En déduire l'expression de la constante d'équilibre en
fonction de la température.
Relation de Kirchhoff : ΔrH°(T) = ΔrH°298 + SDCp DT.
ΔrH°(T) = ΔrH°298 +[2Cp(NH3)-Cp(N2)-3Cp(H2)] DT.
ΔrH°(T) = ΔrH°298 +[2x34,36-29,13-3x28,78] DT.
ΔrH°(T) = ΔrH°298 -46,75(T-298).
ΔrH°298 =2 DfH°(NH3) - 3 DfH°(H2) - DfH°(N2) = 2(-45,9 ) = -91,8 kJ mol-1.
ΔrH°(T) = -91,8 103 +46,75 x298 -46,75 T= -7,79 104-46,75 T.
ΔrS°298 =2 S°(NH3) - 3 S°(H2) - S°(N2) = 2x192,66-3x130,571-191,609= -198 J mol-1K-1.
ΔrG°298 =ΔrH°298 -298 ΔrS°298 = -91,8 103 +298 x 198 =-3,28 104 J / mol.
On applique Gibbs-Helmoltz puis on intègre.
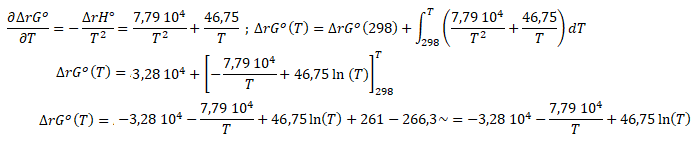
ln Kp = -ΔrG°(T) / RT =3,94 103 / T +9,37 103 / T2-5,62 / T x ln(T).
3. Quel serait le rapport H2 / N2 idéal ?
rapport 3.
|
|
|
|