Concours
technicien-ne en chimie et sciences physiques, Chambéry 2021.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
.
.
|
..
..
......
...
|
Culture générale et scientifique.
1. Que signifient les sigles suivants ?
USMB : université Savoie Mont Blanc.
UFR : unité de formation et de recherche.
CNRS : centre nationnal de recherche scientifique.
CHSCT :comité d'hygiène et de sécurité et des conditions de travail.
HPLC : chromatographie liquide haute performance.
CPG : chromatographie en phase gazeuse.
CMR : cancérigène, mutagène, reprotoxique.
FDS : fiches de données de sécurité.
2. A quoi correspondent les numéros de téléphone suivants ?
119 : numéro d'urgence.
17 : appel àla police ou à la gendarmerie en cas d'urgence.
18 : pompiers.
15 : SAMU.
3.
Convertir dans l’unité donnée. Donner le résultat en notation scientifique.
27 m /s = 27 x3,6 km /h = 97,2 km / h = 9,72 101 km /h..
405 nm = 405 10-9 m = 405 10-3 µm= 4,05 10-1 µm.
3 105 kg = 3 105 x 106 mg = 3 1011 mg.
250 cm3 =0,25 L = 2,5 10-1 L.
3600 kJ s-1 =3600 kW = 3,6 106 W.
4. Citer la loi des gaz parfaits et donner les unités de chaque terme dans le
système international d’unités.
PV = nRT.
P pression (Pa) ; V volume ( m3) ; n quantité de matière (mol) T : température (K).
R = 8,314 J mol-1 K-1.
5. Donner les valeurs des grandeurs physiques suivantes :
Accélération de la pesanteur terrestre : 9,81 m s-2.
Célérité de la lumière 3,0 108 m/s dans le vide.
Nombre d'Avogadro : 6,023 1023 mol-1.
Constante de Planck : 6,63 10-34 m2 kg s-1.
Capacité calorifique de l'eau à 25°C : 4,8 103 J kg-1 K-1.
Pression atmosphérique dans les CNTP au niveau de la mer :101325 Pa.
6. Donner la relation liant une longueur d’onde à son nombre d’onde.
Le nombre d'onde est l'inverse de la longueur d'onde.
7. Dans le spectre des ondes électromagnétiques, complétez le tableau cidessous à l’aide de la liste suivante :
infra-rouge, micro-onde, rayons X, ultra-violets, rayons gamma, visible.
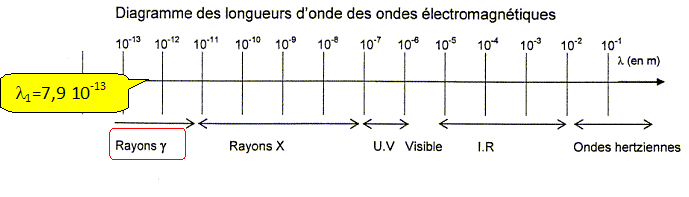 8. Calculer la période d’une onde lumineuse de longueur d’onde 10 pm
8. Calculer la période d’une onde lumineuse de longueur d’onde 10 pm.
l = cT ; T = l / c = 10 x 10-12 / (3 108) =3,33 10-20 s.
9. Une population de 700 individus présente 3 génotypes différents. On
dénombre 336 individus possédant le génotype 1 et 27% possédant le
génotype 2. Calculer le pourcentage d’individus possédant le génotype 3
et en déduire le nombre d’individus de la population possédant le
génotype 3.
Génotype 1 : 336.
Génotype 2 : 700 x 0,27 =189.
Génotype 3 : 700 -189 -336 =175 soit 175 / 700 x100 =25 %.
10. Définir ce qu’est la chimie verte.
La chimie verte prévoit de mettre en oeuvre des principes pour réduire
et éliminer l'usage ou la génération de substances néfastes pour
l'environnement.
Chimie générale.
1. La masse molaire du calcium Ca est de 40 g.mol-1
. Celle du chlore Cl est
de 35,5 g.mol-1
. Convertir la concentration de chlorure de calcium de 125
g.L-1 en mol.mL-1 et en mol.L-1
.
40 /(40+35,5) =0,53 mol / L ou 0,53 / 1000 mol mL-1 =5,3 10-4 mol / mL.
2. La masse molaire du carbone est de 12,001 g.mol-1
. Quelle est la masse
d’un atome de 126C ?
12,001 / NA =12,001 / (6,023 1023)=1,99 10-23 g.
3. Remplir le tableau suivant :
Nom
|
Formule topologique
|
Formule brute
|
Famille
|
cyclopentane
|

|
C5H10
|
cycloalcanes
|
propanone
|

|
C3H6O
|
cétone
|
Toluène
|

|
C7H8
|
dérivé benzenique
|
éthanoate de 1-méthyléthyle
|

|
C5H10O2.
|
ester
|
1-fluoropropanone
|

|
C3H5F
|
fluorocétone
|
Méthyl-2-butan-2-ol
|

|
C5H12O
|
alcool secondaire
|
acide benzoïque
|

|
C7H6O2.
|
acide carboxylique
|
éthanoate de 2 -méthylpropyle
|

|
C6H12O2
|
ester
|
éthanol
|

|
C2H6O
|
alcool primaire
|
acéthylène
|
|
C2H2
|
|
cation ammonium
|
|
NH4+
|
|
eau
|
|
H2O
|
|
ion oxalate
|
|
-OOC-COO-
|
|
ion hydrogénocarbonate
|
|
HCOO-
|
|
|

|
|
o- nitro aniline
|
4. Citer un élément appartenant aux familles suivantes :
Métaux alcalins : sodium, potassium.
Halogènes : Fluor, chlore.
Métaux alcalino-terreux : calcium, magnésium.
Métaux de transition : fer, cobalt.
Gaz rares : néon, hélium.
5. Décrire en 3 phrases maximum le principe de la spectroscopie infrarouge :
Lorsqu’une
molécule absorbe de l’énergie sous la forme d’un rayonnement
infrarouge, les atomes se mettent à vibrer. Ils entrent alors en
oscillation.
Lorsqu’une longueur d’onde l correspond
à la fréquence d’excitation d’une liaison chimique, l’énergie du
rayonnement est absorbée par la molécule. La mesure de l’intensité de
lumière absorbée à chaque longueur l conduit
à un spectre caractéristique du produit étudié ; ce spectre présentant
des bandes d’absorption correspondant à l’excitation de certaines
liaisons chimiques.
6. Décrire en 3 phrases maximum le principe de la spectroscopie UV-visible :
Soumis à un rayonnement dns la gamme 100 nm- 400 nm les
molécules, les ions les complexes sont susceptibles de subir une ou
plusieurs transitions électroniques. Le spectre est représenté comme
une fonction de l'absorbance en fonction de la longueur d'onde.
7. Décrire en 3 phrases maximum le principe de la chromatographie : donner
3 techniques expérimentales de chromatographie.
8. Expliquer la technique utilisée pour déterminer le point de fusion d’un
produit organique.
Prise du point de fusion d'un solide au banc Kofler
9. Définir ce qu’est une réaction de photolyse.
Ensemble des phénomènes de décomposition chimique par la lumière.
10. Définir ce qu’est une réaction d’hydrolyse.
Coupure d'une liaison covalente par l'eau.
11. Donner la définition d’un site nucléophile et d’un site électrophile.
Site nucléophile ;site riche en électrons, ami des noyaux positifs.
Site électrophile : site pauvre en électrons, ami des électrons.
12. Tracer le schéma réactionnel des réactions de Substitution Nucléophile
d’ordre 1 et d’ordre 2 (SN1 et SN2).
 13. Rédiger le protocole expérimental (manipulation, EPI/EPC et verrerie
utilisée) de la dilution d’une solution mère de soude 6M pour obtenir 250
mL d’une solution fille 1M.
13. Rédiger le protocole expérimental (manipulation, EPI/EPC et verrerie
utilisée) de la dilution d’une solution mère de soude 6M pour obtenir 250
mL d’une solution fille 1M.
Port de blouse, gants et lunettes de protection.
Facteur de dilution F = 6.
Prélever 250 / 6 =41,6 mL de solution mère à l'aide d'une burette graduée.
Verser dans la fiole jaugée de 250 mL contenant 1 / 3 d'eau distillée.
Compléter avec de l'eau distillée jusqu'au trait de jauge.
Agiter pour rendre homogène.
14. Rédiger le protocole expérimental (manipulation, EPI/EPC et verrerie
utilisée) de la dilution d’une solution mère d’acide chlorhydrique fumant
(37%, densité 1,19) pour obtenir 500 mL d’une solution fille 0.1M.
Solution mère : masse de 1 L = 1,19 kg.
Masse d'acide : 1,19 x0,37 =0,440 kg.
Quantité de matière d'acide : 440 / M(HCl) = 440 / 36,5 =12,, 1 mol dans 1 L.
Port de blouse, gants et lunettes de protection.
Facteur de dilution F =12,1 / 0,1 = 121.
Prélever 500 / 121 =4,1 mL de solution mère à l'aide d'une burette graduée.
Verser dans la fiole jaugée de 500 mL contenant 1 / 3 d'eau distillée.
Compléter avec de l'eau distillée jusqu'au trait de jauge.
Agiter pour rendre homogène.
|
...
|
....
|
Chimie physique
.
1. Donner la définition du pH.
pH = - log[H3O+]
2. Donner les domaines de stabilité du pH d’une solution aqueuse acide et
d’une solution aqueuse basique.
Acide :0 < pH < 7. Base : 7 < pH <14.
3. Donner l’expression du produit ionique de l’eau Ke et sa valeur.
Ke = [H3O+] [HO- ] = 10-14 à 25°C.
4. Définir ce qu’est une espèce amphotère.
Une espèce amphotère peut jouer le rôle de base ou le rôle d'un acide.
5. Définir ce qu’est une solution tampon. Donner un exemple d’application
d’une solution tampon.
Une solution tampon modère les variations de pH suite à l'ajout modéré
d'un acide ou d'une base forte, suite à une dilution modérée.
6. Donner la définition d’un acide de Lewis et d’une base de Lewis.
Acide de Lewis ; espèce présentant un défaut de doublet électronique.
Base de Lewis : espèce présentant un doublet électronique excédentaire.
7. Donner la définition d’un oxydant et d’un réducteur.
Oxydant : espèce susceptible de gagner un ou plusieurs électrons.
Réducteur : espèce susceptible de céder un ou plusieurs électrons.
8. On considère la pile formée de l’association des deux demi-piles (1) et
(2) suivantes, en utilisant une jonction électrolytique. On néglige la
différence de potentiel associée à la jonction électrolytique.
(1) la demi-pile constituée d’une électrode de platine Pt plongée
dans une solution aqueuse contenant des ions Cl-
, en
contact avec du dichlore Cl2 à une pression de 0.5 bar. Le
platine ne participe pas aux réactions.
(2) la demi-pile constituée d’une électrode de cobalt Co plongée
dans une solution aqueuse contenant des ions Co2+.
Donnée : E(C02+/Co)= -0,280 V/ESH ; E(Cl2 / Cl-)= +1,360 V/ESH
a) Écrire les deux demi-équations d’oxydoréduction associées aux deux couples
rédox.
Réduction du dichlore à la cathode positive : Cl2 +2e- --> 2Cl-.
Oxydation du cobalt à l'anode négative : Co --> Co2++2e-.
b) Écrire la réaction de fonctionnement de la pile.
Cl2 +Co --> Co2++ 2Cl-.
c) Indiquer l’électrode positive et l’électrode négative de la pile. Préciser laquelle
de ces deux électrodes est la cathode et laquelle est l’anode.
Anode négative : cobalt ; cathode positive : platine.
9. Dosage de l’eau de Dakin
Données : K : 39,10 g.mol-1
; Mn : 54,94 g.mol-1;
O 15,99 g.mol-1.
a) De quelle couleur paraît la solution de permanganate de potassium ?

Le maximum d'absorption se situe vers 530 nm. (jaune). La couleur complémentaire du jaune est le violet.
b) Déterminer le degré d’oxydation de Mn dans KMnO4.
1 +x +4*(-2) =0 : x = VII.
c) Quelle couleur est absorbée par la solution de permanganate de potassium ?
Le jaune
d) Quelle est pour une solution de permanganate de potassium, la longueur d’onde du
maximum d'absorption lmax ?
530 nm
e) Pour réaliser des mesures d’absorbance, le spectromètre est généralement réglé
sur la longueur d’onde lmax correspondant au maximum d’absorption du spectre
d’absorption de la lumière étudiée. A votre avis, pourquoi choisit-on de se placer à
la longueur d'onde lmax ?
Pour obtenir le maximum de précision.
f) Vous devez effectuer un contrôle de qualité pour vérifier la concentration massique
en permanganate de potassium dissous. La formule du permanganate de
potassium est KMnO4. Pour effectuer l’étude de cette solution nous mettons à votre
disposition un spectrophotomètre réglé à une longueur d’onde dans le vide lmax =
540 nm.
Vous devez préparer une gamme étalon et vous avez à votre disposition :
–
une solution de permanganate de potassium de concentration en soluté : C0 =
5,00.10–4 mol.L-1
– 5 béchers de 100 mL
– une pissette d’eau distillée
– 4 fioles
jaugées : 2 de 50 mL, 2 de 100 mL
– 3 pipettes jaugées : une de 5,0 mL, une de
10,0 mL et une de 20,0 mL
Indiquez comment préparer les quatre solutions de concentrations suivantes : C1=
0,50.10-4 mol.L-1 ; C2= 1,00.10-4 mol.L-1
; C3= 1,50.10-4 mol.L-1
; C4= 2,00.10-4
mol.L-1
. Vous proposerez un protocole détaillé pour l'une des solutions.
Solution C1 : facteur de dilution F =5 / 0,5 = 10.
Fiole jaugée de 50 mL et pipette jaugée de 5,0 mL.
Prélever5,0 mL de solution mère à l'aide d'une pipette jaugée
Verser dans la fiole jaugée de 50,0 mL contenant 1 / 3 d'eau distillée.
Compléter avec de l'eau distillée jusqu'au trait de jauge.
Agiter pour rendre homogène.
g) Tracer la courbe A=f(C) ; Vous y porterez toutes les informations que vous jugez
pertinentes.

h) Comment s’appelle la loi qui relie l’absorbance à la concentration ? Ecrivez-là, vous
indiquerez à quoi correspondent les différents termes ainsi que leurs unités.
Loi de Beer Lambert.
A = e l c.
A absorbance ; e : coefficient d'extinction molaire L mol-1 cm-1;
l largeur de la cuve cm ; c concentration mol/ L.
i) Pour vérifier la teneur en permanganate dans une bouteille d’eau de Dakin, un
échantillon est analysé dans les mêmes conditions que la gamme étalon. Une
absorbance de 0,125 est obtenue. En utilisant votre graphe, déterminez la
concentration en permanganate dans l’eau de Dakin.
c = 0,125 /(2,17 103) =5,8 10-5 mol / L.
KMnO4 : 10 mg / L ; M(KMnO4) =39,10 +54,94 +4 x15,99 =158 g / mol.
10 10-3 /158=6,3 10-5 mol / L.
Ecart relatif ( (6,3-5,8) / 6,3 x 100 ~ 8 %.
Valeur supérieureà 5 %, la concentration indiquée n'est pas correcte.
10. Synthèse organique.
On souhaite réaliser la réduction du
3-phénylpro-2-ènal en 3-phénylprop2-èn-1-ol. On dispose de deux
protocoles utilisant deux réducteurs
différents. L’un utilise du dihydrogène en présence de nickel de Raney
comme catalyseur, l’autre du tétrahydruborate de sodium (NaBH4). Ces
protocoles ne précisent pas si la réduction concerna la fonction aldéhyde
ou la double liaison C=C, et la réaction peut conduire à différents produits (A), (B)
ou (C).

L’analyse IR de (R) fournit le spectre 0, alors que la réaction avec le
dihydrogène en présence de nickel de Raney fournit le spectre 1, et le
spectre 2 correspond au produit de la réaction en présence de NaBH4.
a) Donner le nom des molécules (A), (B) et (C).
A : 3 -phénylpropanal.
B : 3 -phénylpropan-1-ol.
C :(E) 3 -phénylpropan-2-ène-1-ol..
b) Associer les molécules à leur spectre correspondant et indiquer le protocole qui
permet d’obtenir le produit désiré.

La réduction de l'aldehyde en alcool par NaBH4 donne C.
Hygiène et sécurité.
1. Expliquer ce qu’est le triangle du feu ?

La combustion peut se p^roduire si on réunit au minimum 3 éléments : un
combustible, un comburant (dioxygène) et une énergie d'activation (
chaleur).
2. A quel danger correspondent les pictogrammes suivants ?

3. Définir le CAS d’un produit chimique.
Numéro d'enregistrement unique auprès de la banque de données de Chemical Abstracts Service.
4. Dans une armoire de produits chimiques, comment sont classés les
acides, les bases, les solvants, les produits minéraux et organiques ?
acides et bases, substances corrosives.
solvants : issus de la pétrochimie.
5. Comment est stocké le sodium métallique ? Quelles sont les précautions
à prendre pour le manipuler ?
Stokage dans une huile, dans le kérozène.
Manipuler sous gaz inerte, protéger de l'humidité.
Porter des gants des vétements de protection, des lunettes.
Sciences physiques
1. La chaleur spécifique massique de l’eau est c = 4,19 J.g
-1
.K
-1
. Calculer
l’énergie nécessaire pour amener un litre d’eau de 20°C à ébullition.
Q = mc Dq = 1000 x4,19 x(100-20) =3,35 105 J. ( sans passage à l'état gazeux).
2. On donne une résistance de 1000 W alimentée par une tension de 220
V. Déterminer la valeur du courant qui la parcourt.
I = P / U = 1000 / 220=4,54 A.
3. Quelle est l’énergie dissipée par cette résistance ?
Energie ( Joule ) puissance ( watt) fois durée (s).
4. Tracer un schéma électrique comprenant un générateur de tension
continue et une résistance. Indiquer le sens de circulation du courant et
des électrons. Montrer le branchement d’un voltmètre et d’un
ampèremètre dans ce circuit électrique.

|
|