Titrage
du diiode,
estérification, physique, concours technicien en chimie et sciences physiques
2020.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
.
.
|
..
..
......
...
|
I. CHIMIE.
1. Autour d’un titrage en
solution aqueuse dans le 2nd degré.
Données : masses molaires atomiques en g.mol-1 : M(H) = 1,0
; M(O) = 16 ; M(Na) = 23 ; M(S) = 32 ; M(I) = 127 ; M(Cl) = 35,5.
Potentiels standards d’oxydoréduction à 298 K (et pH=0) :
I2 (aq) / I- (aq): E°1 = 0,53 V :
S4O62-(aq) / S2O32-(aq):
E°2 = 0,08 V
Le numéro atomique d’un atome d’iode est Z = 53. Son nombre de masse A
= 127.
1. Décrire la
composition de l'atome d'iode.
53 électrons ; 53 protons et 127-53 =74 neutrons.
- Réalisation d’une solution aqueuse de
diiode (I 2).
On utilise la procédure suivante :
- Préparer 33,2 g d’iodure de potassium (KI) de masse molaire M =
166,01 g.mol -1.
- Dissoudre dans environ 0,5 L d'eau en agitant.
- Préparer 25,4 g de diiode de masse molaire M = 253,81 g.mol -1.
- Verser dans la solution aqueuse de KI.
- Compléter avec de l’eau pour réaliser 1 L de solution.
2. Justifier
l'ajout d'ion iodure.
On accroît
fortement la solubilité de I2 dans
l’eau en ajoutant de l’iodure de potassium KI en raison de l’existence
d’un équilibre de complexation : I2 + I- =
I3- ; Kf =
102,9.
Toutes les molécules de diiode passent dans la phase aqueuse sous forme
d'ion I3-.
3. Déterminer la
concentration Cmère en I2 de cette solution.
25,4 / (127 x2) =0,100 mol.
0,100 / 1 = 0,10 mol / L.
Vous devez préparer 500 mL de concentration Cfille = 1,00.10-3
mol.L-1 à partir de la solution précédente.
4. Citer le
matériel.
5. Décrire la
manière de procéder.
Facteur de dilution : 100.
Prélever 500 / 100 = 5,0 mL de solution mère à l'aide d'une pipette
jaugée.
Verser dans une fiole jaugée de 500 mL.
Compléter avec de l'eau distillée jusqu'au trait de jauge.
Agiter pour rendre homogène.
- Préparation d’une solution aqueuse de thiosulfate de sodium.
Pour réaliser le dosage de la solution de diiode précédemment obtenue,
on utilise une solution de thiosulfate de sodium de concentration C1
= 1,00.10-2 mol.L-1.
6. Donner la
formule brute du thiosulfate de sodium.
Na2S2O3.
7. Déterminer la
masse de ce solide nécessaire pour préparer 500 mL de cette solution.
n = 0,5 x0,010 = 5,0 10-3 mol.
M(Na2S2O3) = 23 x2 +2 x32 + 3x16=158 g /
mol.
m = 158 x 5 10-3 =0,79 g.
8. Ecrire les
demi-équations électroniques et l'équation bilan de ce titrage.
I2
(aq) +2e- =2 I- (aq).
2S2O32-(aq)
=
S4O62-(aq) +2e-.
2S2O32-(aq)
+
I2 (aq) =
S4O62-(aq) +=2
I- (aq).
L’enseignant a
prévu un titrage d’un volume V = 50,0 mL de solution de Cfille
= 1,0.10-3 mol.L-1 par la solution de thiosulfate
de sodium de concentration C1.
Un élève de STL veut prélever ce volume V avec une fiole jaugée de 50
mL. Un autre propose l’utilisation d’une pipette jaugée de 50 mL de
même classe.
9. Choisir la
solution la plus pertinente.
Pipette jaugée de 50 mL, le volume prélevé est plus précis.
10. Déterminer le
volume équivalent.
A l'équivalence n(S2O32-)= 2(I2).
C1 Véq =2V Cfille ; Véq
=2 x50,0 x1,0 10-3 / (1,00 10-2 )=10,0 mL.
11. Faire un schéma annoté du
dispositif de titrage.
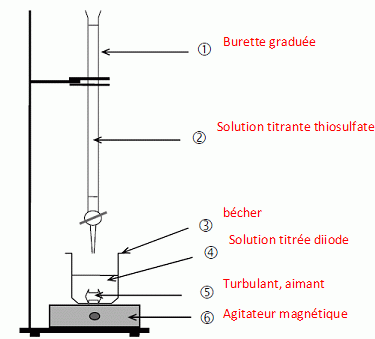
12. Comment repère
t-on l'"quivalence ?
Avant l'équivalence, dans le becher, le diiode est
en excès ; après l'équivalence l'ion thiosulfate est en excès.
rôle de l'empois d'amidon :
indicateur de fin de réaction.
En présence de diiode , l'empois d'amidon forme un complexe de couleur
violet foncé ( couleur de la solution avant l'équivalence) ; après
l'équivalence, toutes les espèces sont incolores. Un changement de
teinte est observé à l'équivalence.
13.
La séance est prévue pour 4 classes comportant
chacune 9 binômes par demi-groupe. Déterminer le volume de solution de
thiosulfate de sodium nécessaire.
9 x2 x4 = 72 binômes.
Burette braduée de 25 mL soit 25 x72 =1800 mL ( soit environ 2 L).
14. On pourrait
repérer l'équivalence à l'aide d'une méthode potentiométrique. Quelles
électrodes et appareils choisir ?
L'électrode
de référence utilisée ici est une électrode au calomel saturée (ECS),
c'est à dire une électrode de platine (Pt) recouverte de mercure (Hg)
sur lequel est déposé du calomel Hg2Cl2.
Cette électrode est dite saturée car la solution dans laquelle plonge
l'électrode ainsi constituée est une solution aqueuse saturée en
chlorure de potassium KCl.
L'électrode
de mesure ( platine) doit être inattaquable en milieu acide ( pH=0).
Appareil de mesure : voltmètre.
15. La verrie mise
à disposition n'a pas été lavée. Préciser les rinçages à effectuer.
Laver avec de l'eau ; rincer la burette graduée avec la solution de
thiosulfate et le becher avec de l'eau distillée.
16. La
détermination de la concentration de diiode peut également être
réalisée par spectrophotométrie. Expliquer le principe de ce dosage.
On
réalise une échelle de teintes à partir de solutions de concentrations
connues de diiode.
A l'aide d'un spectrophotomètre, on mesure l'absorbance Ai de
chaque solution Di de
diode, puis celle de la solution S à doser.
On choisit une longueur d'onde pour laquelle la solution de diiode
présente un maximum d'absorption. (475 nm).
On
trace la courbe d'étalonnage de l'absorbance en fonction de la
concentration en diiode.
17. Que faire des solutions usagées
en fin de TP ?
Diiode : collecte dans un bidon séparé.
Thiosulfate de sodium : évier.
Une solution de thiosulfate trouve une application au laboratoire de
physique afin de montrer aux élèves la diffusion de la lumière par des
particules colloïdales de soufre. Pour ce faire on verse dans une
solution de thiosulfate de sodium quelques gouttes d’une solution
d’acide chlorhydrique ce qui provoque une réaction de dismutation.
- Préparation d’une solution diluée d’acide chlorhydrique
Une bouteille contenant une solution commerciale d’acide chlorhydrique
porte les indications suivantes : proportion massique en acide pur : 37
% ; d = 1,19.
18. Donner la
formule brute de l'acide chlorhydrique. HCl.
19. Calculer sa
masse molaire. 1+35,5 = 36,5 g / mol.
20. Calculer la
concentration de la solution du commerce.
Masse de 1 L de solution : 1,19 kg.
Masse d'acide pur : 1,19 x0,37 =0,440 kg.
Concentration : 440 / 36,5 =12,0 mol / L.
On souhaite préparer 100 mL d’une solution diluée d’acide chlorhydrique
de concentration 2,5 mol.L-1 notée S0.
21. Quel volume de
solution commerciale faut-il prélever ?
Facteur de dilution : 12,0 / 2,5 =4,8.
Volume à prélever : 100 / 4,8 ~20,8 mL
22. Donner le
protocole à suivre.
prélever 20,8 mL de solution commerciale ( burette graduée).
Verser dans une fiole jaugée de 100 mL contenant 1 / 3 d'eau distillée.
Compléter avec de l'eau distillée jusqu'au trait de jauge. Agiter pour
rendre homogène.
23. Que signifie
INRS ?
Institut national de recherche et de sécurité.
24. Que signifie
DUERP ?
Document unique d'évaluation des risques professionnels.
|
...
|
....
|
2. Autour d'un protocole de chimie
organique dans le supérieur.
Un élève de TIPE
souhaite réaliser la synthèse de l’éthanoate de 3-méthylbutyle (ou
acétate d’isoamyle) à l’aide du protocole suivant trouvé sur internet :
« Dans un erlenmeyer, introduire dans l'ordre avecprécaution:
· 15 mL de A à l'aide d'une éprouvette graduée de 25 mL · 12 mL de B à
l’aide d’une pipette graduée et d’une propipette.
· un barreau aimanté
Après avoir surmonté l’erlenmeyer d’un réfrigérant à air, agiter
pendant 1 heure à température ambiante. »
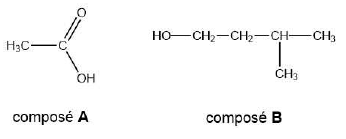
25. Nommer A et B.
A : acide éthanoïque ; B : 3-méthylbutan-1-ol.
26. Nommer le type
de réaction. Estérification.
27. Ecrire la
formule semi-développée de l'éthanoate de 3-méthylbutyle.
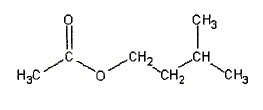
28. La réaction
étant très lente, proposer deux moyens pour l'accélérer.
Catalyseur : acide dulfurique concentré.
Utiliser un dispositif de chauffage à reflux, la température est un
facteur cinétique..
29. Schématiser le
montage.
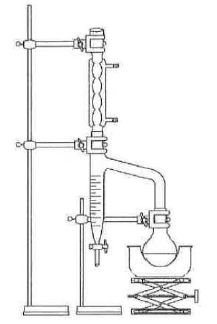
Le tube décanteur
de Dean-Stark est rempli de cyclohexane jusqu’à la
partie supérieure. Un volume de 10 mL de cyclohexane est aussi ajouté
dans le milieu réactionnel. On chauffe à reflux, à ébulllition douce.
On suppose que, lors de cette ébullition, seuls l’eau et le cyclohexane
s’évaporent.
30. Cette réaction étant limitée,
proposer deux modifications afin de la rendre totale.
Eliminer le produit le plus volatil au fur et à mesure qu'il se forme.
Utiliser l'un des réactif en large excès.
31. Cette réaction
peut être suivie par CCM. Shématiser les étapes clés de la ralisation
d'une CCM.
32. Expliquer le
principe d'une CCM.
But : séparer et identifier les
constituants d'un mélange.
Mise en
oeuvre : placer
l'éluant dans le bécher ( hauteur 5 mm), mettre un couvercle.
Sur la plaque CCM, tracer 2 traits au crayon de papier à 7 ou 8 mm des
extrémités.
Sur le trait inférieur faire les dépots (pipette pasteur), espèces à
analyser et substances étalon.
Placer la plaque dans le bécher, fermer, retirer dés que l'éluant
atteint le trait supérieur.
33. On a obtenu la CCM suivante, le produit est-il pur ? Justifier.
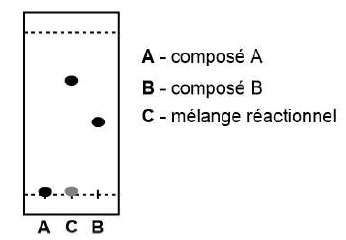
Le mélange réactionnel montre une seul tache, un seul produit et l'absence des réactifs A et B. Le produit est pur.
34. Que signifie HPLC ?
Chromatographie en phase liquide haute performance.
35. Citer trois différences entre cette technique et la CCM.
Le mélange liquide à séparer est entraîné par un éluant liquide.
La phase stationnaire est constituée de grains, gels, matrice solide, au lieu de la plaque CCM.
Fonctionnement automatique du procédé. Une pompe pousse l'éluant à une
certaine vitesse alors que dans une CCM, l'éluant migre par capillarité.
36. L'ester est purifié par distillation fractionnée. Schématiser ce montage.
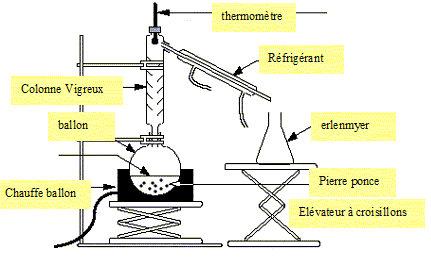
37. Expliquer le principe d'une distillation fractionnée.
La distillation fractionnée permet
de séparer les constituants d'un mélange liquide- liquide miscibles,
possédant des températures d'ébullition différentes. Le constituant le
plus volatil distille en premier ; la séparation est d'autant plus
facile que les températures d'ébullition sont différentes.
38. On obtient 9,36 g d'éthanoate de 3-méthylbutyle. Calculer le rendement.
A : densité 1,05 ; V = 15 mL ; M = 60 g/mol; masse :15 x 1,05 =15,75 g ; n = 15,75 / 60 =0,2625 mol.
B : densité =0,8 ; V = 12 mL ; M = 88 g/mol ; masse =12 x0,8 =9,6 g ; n = 9,6 /88 =0,109 mol ( en défaut).
Quantité de matière théorique d'ester : 0,109 mol ; M =130 g / mol ; masse =0,109 x130 =14,2 g.
Rendement 9,36 / 14,2 ~0,66 (66 %).
39. Quelle technique permet d'obtenir le spectre suivant ?
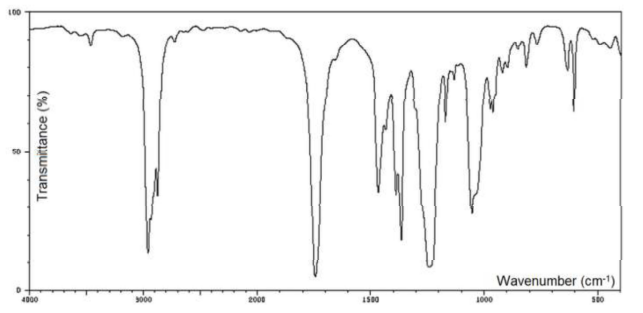
Spectroscopie IR.
40. Quel type d'information cette technique permet -elle d'obtenir ?
Détermination des différentes fonctions présentes dans une molécule.
41. En quoi le spectre suivant est-il complémentaire du précédent ?
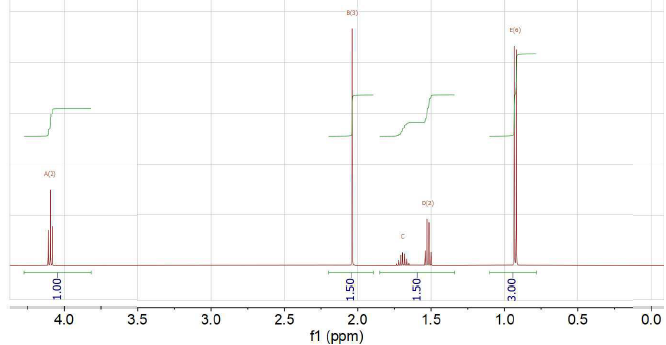
La structure ou les différents fragments de structure sont déterminés par RMN.
42. Le spectre a été réalisé dans du CDCl3. Pourquoi ?
Il s'agit d'un solvant permettant de dissoudre un grand nombre d'échantillon avec une concentration élevée.
43. Que signifie les pictogrammes suivants ?

44. Quels EPI faut-il utiliser pour cette préparation ?
Port de blouse, gants et lunettes de protection.
II. PHYSIQUE
4. Optique ondulatoire.
Le montage ci-dessous est un montage interférométrique utilisé couramment en laboratoire.

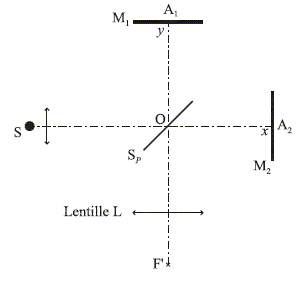
45. Donner le nom de ce dispositif.
Interféromètre de Michelson.
46. Nommer les différents éléments.
Un
interféromètre de Michelson est constitué d'une lame
semi-réfléchissante, non absorbante, appelée séparatrice Sp dont les
facteurs de transmission et de réflexion sur les amplitudes valent ½ et
de deux miroirs plans M1 et M2 perpendiculaires l'un à l'autre.
Les réglages de la séparatrice et de la compensatrice sont réalisés
grossièrement avec un laser rouge de puissance de sortie 1mW et de
classe 1.
47. Donner un ordre de grandeur de la longueur d'onde de ce laser. 650 nm.
48. Quelles consignes de sécurité donner aux étudiants utilisant ce laser ?
Laser sans danger pendant son utilisation.
49. 50. Expérience du bleu du ciel résultant de la dismutation des ions thiosulfate en milieu acide.
Lampe quartz iode ; filtre anticalorique ; lentille convergente de
focale 20 cm ; cuve de dimensions 6 cm ; 2 cm ; hauteur = 3 cm ; écran.
Solution thiosulfate à 20 g / L et acide chlorhydrique 6 mol / L.
51. Quelle indication est donnée par la lecture de ce vernier qui est au 1 / 50 ?

17,09.
5. Électricité.
Un professeur a réalisé un circuit RLC série et veut observer
simultanément l’évolution du courant circulant dans le circuit ainsi
que l’évolution de la tension aux bornes du GBF au cours du temps.
52. Schématiser le montage expérimental.
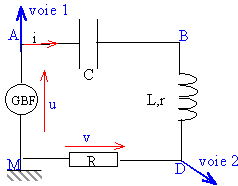
53. Avantage et inconvénient des câbles coaxial-banane et banane-banane.
Avantage du câble coaxial : le blindage protège le conducteur interne des perturbations.
Sur la capture d’écran ci-après on observe sur la voie 1 la tension aux
bornes du GBF, et sur la voie 2 la tension aux bornes de la résistance.
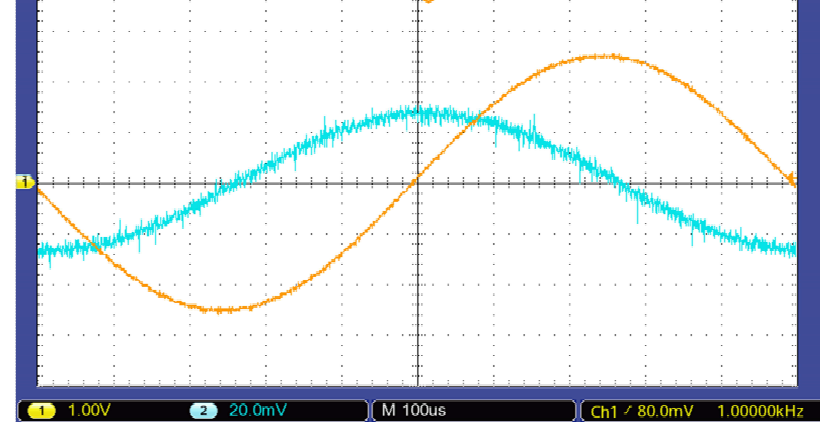
54. Déterminer l'amplitude, la fréquence du signal sur la voie 1.
2,5 V ; 1 kHz.
55. Déterminer le déphasage entre les signaux.
Le signal voie 1 est en avance sur le signal voie 2 de 2,6 carreaux.
Une période ( 2p radians) correspond à 10 carreaux.
2 p x2,6 / 10 ~1,6 radians.
56. Proposer un mode opératoire permettant de déterminer la valeur de la fréquence de résonance.
Faire varier la fréquence du GBF jusqu'à observer deux courbes en phase ( non décalées).
Un élève observe dans son cas (R = 10 W, L= 0,1 H, C = 0,1 mF) une
chute de tension aux bornes du GBF » lorsqu’il se place à la fréquence
de résonance.
57. 58. Cette baisse est-elle due à une erreur de lecture de l'étudiant ou a-t-elle une origine physique ?
Tension de sortie du GBF : u = E -R i.
A la résonance d'intensité, une augmentation de Ri entraîne une chute de tension aux bornes du GBF.
59. Comment éviter cette baisse de tension ?
Emploi d'un A.O suiveur ; diminuer suffisamment la tension d'alimentation fournie par le GBF.
60. Lister le matériel nécessaire à l'équipement de 8 paillasses élèves et une paillasse professeur pour ce TP RLC série.
Par groupe : GBF; condensateur, bobine, résistance, interrupteur, oscilloscope, fils.
61. Donner un ordre de grandeur de l'impédance de sortie d'un GBF utilisé en lycée. 50 ohms.
62. Donner un ordre de grandeur de l'impédance d'entrée d'un câble coaxial. 50 ohms.
|
|













