Concours
externe adjoint technique de recherche et de formation principal
Versailles
2021.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
.
.
|
..
..
......
...
|
I.
Chimie.
A Décoloration de l'éosine.
L’éosine est un colorant rouge solide de masse molaire M = 691,9 g.mol-1
. Un professeur
prépare une activité expérimentale sur la décoloration de l’éosine par l’eau de Javel et
envisage un suivi de cette cinétique par spectrophotométrie.
Q1 - La concentration en masse de la solution aqueuse de colorant à utiliser par les élèves
est 2,8.10-3 g.L
-1
. Calculer la masse d’éosine nécessaire à la préparation d’un litre de cette
solution par dissolution.
2,8 mg.
Q2 - Le laboratoire dispose de balances de pesée, dont les précisions vont de 0,1 g près à
0,001 g près. Expliquer pourquoi la solution demandée ne peut pas être préparée par une
unique dissolution.
La balance la plus précise est à 1 mg près. On ne peut pas peser avec précision 2,8 mg.
Q3 - Une stratégie de préparation d’un litre de solution aqueuse d’éosine à 2,8.10-3 g.L-1
consiste en une dissolution suivie d’une dilution. Lister précisément le matériel nécessaire à
l’ensemble de cette préparation 0,28 g / L puis diluer 100 fois.
Fiole jaugée de 1 L ; pipette jaugée de 10 mL ; bécher, pisette d'eau distillée.
Q4 - La séance d’activité expérimentale est programmée pour 3 groupes de spécialité de
terminale composés chacun de 20 élèves regroupés en binômes. Le professeur a indiqué une
quantité nécessaire et suffisante de 50 mL de solution d’éosine par paillasse. Déterminer si la
préparation d’un litre de solution est suffisante pour l’ensemble des terminales du lycée.
10 binômes fois 3 groupes = 30 binômes soit 30 x50 = 1500 mL = 1,5 L. ( 1 L n'est pas suffisant ).
Q5 - Parmi les appareils représentés ci-dessous, choisir celui correspondant à un
spectrophotomètre.

Q6 - A l’aide du document, déterminer en justifiant la couleur de la solution préparée..

Le maximum d'absorption est vers 530 nm ( vert). La solution possède la couleur complémentaire du vert soit le magenta.
Q7 - Préciser le solvant à prévoir pour faire le blanc de l’appareil et justifier le fait que des
cuves en plastique soient adaptées pour la séance.
Solution aqueuse, le solvant utilisé pour le blanc est l'eau.
Les cuves en plastique peuvent être utilisées en spectroscopie UV visible.
Q8 - Indiquer dans quel cas il est préconisé d’utiliser des cuves en verre.
Les cuves en verre sont utilisables uniquement dans la partie visible du spectre.
L’eau de Javel est une solution aqueuse incolore d’hypochlorite de sodium (Na+
(aq), CℓO-
(aq)) et
de chlorure de sodium (Na+
(aq), Cℓ-
(aq)). Un berlingot commercial étiqueté à 4,8 % de chlore actif
correspond à une solution de concentration en hypochlorite [CℓO-
]0 = 0,72 mol.L-1
. La
concentration de la solution à préparer pour les élèves est de 0,48 mol.L-1
.
Q9 - Indiquer la position de la colonne de l’élément chimique chlore Cℓ dans la classification
périodique.
Colonne 17, celle des halogènes.
Q10 - Calculer le facteur de dilution à appliquer pour la préparation de la solution d’eau de
Javel à partir du berlingot commercial.
F = 0,72 / 0,48 =1,5.
Au laboratoire, vous retrouvez un flacon noté « eau de Javel diluée » sans autre précision, et
vous souhaitez déterminer sa concentration par titrage pour savoir s’il est possible de l’utiliser.
Cela se fait en deux étapes :
Etape 1 : réaction avec les ions iodures
Les ions hypochlorite ClO-
(aq) oxydent les ions iodures I-
(aq) en milieu faiblement acide. Les ions
I
-
(aq) sont ajoutés en excès pour que tous les ions ClO-
(aq) réagissent.
ClO-
(aq) + 2 H+
(aq) + 2 I-
(aq) = Cl-
(aq) + I2(aq) + H2O (1)
Etape 2 : réaction de titrage du diiode obtenu
Le diiode I2(aq) formé est titré par les ions thiosulfate S2O3
2-
(aq).
I2(aq) + 2 S2O3
2-
(aq) --> 2 I-
(aq) + S4O6
2-
(aq) (2)
Q11 - Ecrire tous les couples d’oxydo-réduction mis en jeu dans les réactions (1) et (2) en
précisant le rôle (oxydant ou réducteur) des espèces réactives utilisées.
ClO-
(aq) oxydant / Cl-
(aq)
I2(aq) oxydant (2)/ I-
(aq) réducteur (1)
S4O6
2-
(aq) / S2O3
2-
(aq) réducteur.
Lors de l’étape (2), la solution titrante de thiosulfate de sodium (2 Na+
(aq) ; S2O3
2-
(aq)) utilisée a
pour concentration C2 = 0,200 mol.L-1
. Juste avant l’équivalence, le mélange devient jaune
clair, et on y ajoute quelques gouttes d’une solution d’empois d’amidon. Le volume relevé à
l'équivalence est VE = 14,4 mL.
Q12 - Légender le schéma de ce titrage :
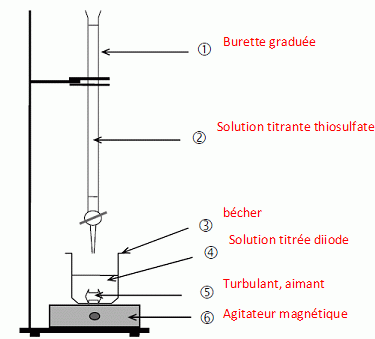
Q13 - Indiquer le rôle de l’empois d’amidon.
indicateur de fin de réaction.
En présence de diiode , l'empois d'amidon forme un complexe de couleur
violet foncé ( couleur de la solution avant l'équivalence).
Q14 - Sachant que la relation à l’équivalence entre les quantités de matière des réactifs mis
en jeu s’écrit n(S2O3
2-
(aq)) = 2 n(I2(aq)), déterminer la quantité initiale de diiode de l’étape 2.
n(I2(aq) =0,5 C2VE =0,5 x 0,200 x14,4 10-3 =1,44 10-3 mol.
Q15 - En déduire la quantité n(CℓO-
) d’ions hypochlorite dans le volume V1 = 20,0 mL prélevé
de la solution d’eau de Javel, puis la concentration [CℓO-
]1 de la solution du flacon trouvé au
laboratoire. Conclure si elle peut être utilisée pour la préparation de l’activité expérimentale.
n(CℓO-
) =n(I2(aq) =1,44 10-3 mol dans 20,0 mL soit 1,44 10-3 x1000 / 20 =7,20 10-2 mol / L.
Cette valeur étant différente de 0,48 mol / L, elle ne convient pas.
Q16 - Plusieurs panneaux de signalétique liés à la sécurité sont présents dans la salle de
travaux pratiques. En choisir deux indiquant la présence d’un dispositif pouvant être utilisé
suite à une projection accidentelle d’eau de Javel dans les yeux d’un élève.

Q17 - Donner la signification du sigle FDS.
Fiche de données de sécurité.
Q18. Expliquer la signification des pictogrammes de danger indiqués.

Corrosif et danger pour l'environnement.
Q19 - Indiquer la formule chimique et le nom exact du gaz toxique dégagé par réaction entre
un acide et l’eau de Javel.
Dichlore Cl2.
Q20 - Parmi les bidons de récupération suivants disponibles au laboratoire, choisir celui dans
lequel verser les déchets d’eau de Javel : - solutions basiques - solutions acides - solvants organiques - solutions de métaux lourds.
B - Synthèse du paracétamol
Un professeur prépare une activité expérimentale de synthèse du paracétamol et
fournit à l’agent de laboratoire une fiche de préparation dont un extrait est reproduit ci-après :
Etapes du protocole de synthèse :
- Dans un erlenmeyer placer le para-aminophénol, l’eau distillée, le solvant de synthèse et un
barreau aimanté. Adapter un réfrigérant à air et chauffer au bain-marie.
Laisser refroidir.
Ajouter l’anhydride acétique et remettre au bain-marie.
Laisser refroidir à l’air puis dans un bain d’eau glacée.
Filtrer sous vide le solide obtenu.
Mettre à l’étuve.
Déterminer la température de fusion du solide obtenu.
Effectuer une chromatographie sur
couche mince avec 3 dépôts : para-aminophénol, solide obtenu, paracétamol commercial,
tous dissous dans l’éthanol.
Procéder à la recristallisation dans l’eau du solide obtenu. Filtrer sous vide. Mettre à l’étuve.
Q21 - Donner la formule semi-développée puis la formule brute de la molécule de paracétamol
synthétisée lors de cette expérience.

Q22 - Déterminer la formule brute du produit secondaire X formé pendant cette synthèse.

Q23 - Parmi les produits à mettre à disposition, choisir ceux devant être installés sous la hotte
aspirante de la salle.
Anhydride éthanoïque et para aminophénol.
Q24 - Expliquer la différence entre les phrases de type H ainsi que celles de type P.
Phrase de typa H : danger ; phrases de type H : conseils de prudence.
Q25 - Proposer le matériel à disposer à proximité du flacon d’anhydride éthanoïque dont un
volume de 2,5 mL doit être prélevé par les élèves.
Liquide et vapeurs inflammables : présence extincteur.
Q26 - Le prélèvement précédent peut aussi être réalisé par pesée. Calculer la masse
d’anhydride correspondante.
Masse volumique anhydride éthanoïque : 1,08 g / mL
1,08 x 2,5 =2,7 g.
Q27 - Parmi les dispositifs suivants, choisir celui qui est décrit dans le protocole pour chauffer
le milieu réactionnel lors de la synthèse :
 Q28 - Citer deux intérêts d’un tel montage.
Q28 - Citer deux intérêts d’un tel montage.
Accélère la réaction, la température est un facteuur cinétique.
On évite les pertes de matière, les vapeurs se condensent dans le réfrigérant et retombent dans le milieu réactionnel.
Q29 - Nommer le matériel à installer pour l’étape de filtration sous vide.
Büchner + pince et trompe à vide.
Q30 - Les élèves utilisent l’étuve pour faire sécher leur solide récupéré après filtration.
Proposer une température adaptée de réglage de l’étuve.
Température fusion paracétamol = 169 °C. Température choisie inférieure à 169 °C. ( 100 °C par exemple)
Q31 - Nommer l’appareil représenté sur la photo ci-contre. 
Ban Koffler.
Q32 - Indiquer comment étalonner cet appareil.
Allumer le banc au moins 15 minutes avant son utilisation.
Etallonage à l'aide d'un solide dont la température de fusion est connue.
Q33 - Pour la préparation par les élèves des échantillons à déposer sur la plaque CCM, le
professeur a demandé à disposer de flacons compte-gouttes d’éthanol. Lister les informations
à indiquer sur l’étiquette de ces petits flacons.
Liquide et vapeur inflammable ; irritation des yeux. Tenir à l'écart
des sources de chaleur et port d'un équipement de protection des yeux.
.
Q34 - A la fin de la séance les élèves mettent en œuvre une recristallisation du paracétamol
solide synthétisé. Donner le but et le principe de cette technique expérimentale avant d’en
décrire succinctement un protocole.
But : purification.
Dissoudre à chaud dans le minimum de solvant puis laisser refroidir.
|
...
|
....
|
Physique.
A- Les trous d’Young.
Un lundi matin, vous apprenez qu’il vous faut commander un jeu de 9 trous d’Young, pour une
activité expérimentale le lundi matin de la semaine suivante.
FRAIS DE PORT OFFERTS* dès 80 € d'achat
Référence : 212092.
Diapositive : Trous d'Young à écartement variable 9,30€ HT
TVA (taux standard) 20%
Livraison normale (Sous 8 jours pour toute la métropole). Frais d'envoi : 9.50 € TTC
Livraison express* (48h) Frais d’envoi supplémentaires : 9.50 € TTC
* Seuls les frais de livraison normale sont offerts
Q36 - Calculer le prix TTC d’une diapositive, en justifiant la démarche.
9,30 x 1,20 =11,16 €.
Q37 - Calculer le prix de la commande en justifiant les choix éventuellement faits.
9 x11,16 =100,44 €. Livraison normale.
Q38 - Attribuer les domaines de longueur d’ondes correspondants :
ultraviolet, visible, infra-rouge et rayons X.

Q39 - Parmi les domaines de longueur d’onde évoqués à la question précédente, indiquer
celui qui présente le plus de risques pour l’être humain.
Plus la longueur d'onde est courte, plus le danger est grand : Rayons X.
Q40 - Indiquant les valeurs des longueurs d’ondes qui
délimitent le domaine visible.
400 nm à 800 nm.
Q41 - Donner la signification du pictogramme présent sur le laser et sur sa notice.

Rayonnement laser.
Q42 - Déterminer la couleur du laser en justifiant.
650 nm correspond au rouge.
Q43 - Donner la tension avec laquelle il faut alimenter le laser pour qu’il fonctionne
correctement.
230 V.
Q44 - Expliquer ce que l’on observe si on interpose un filtre bleu devant le laser.
Absence de lumière.
Le filtre absorbe le rouge ; il ne laisse passer que le bleu.
Q45 - Indiquer le risque pour le filtre.
Destruction par le rayonnement laser.
Q46 - En déduire la fréquence du laser en Hz (en écriture scientifique) puis la convertir en
GHz.
f = c / l = 3,0 108 / (650 10-9)=4,6 1014 Hz ou 4,6 105 GHz.
On utilise ce laser dont le faisceau pénètre dans un dispositif de trous d’Young de diamètre d
et séparés par une distance a situé à une distance D = 0,80 m d’un écran blanc.
Q47 - Faire un schéma légendé représentatif de l’expérience.
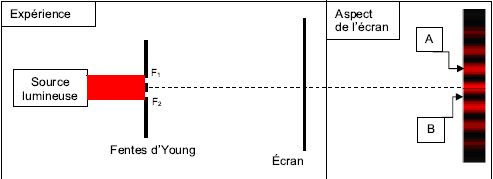
Q48 - Nommer les phénomènes mis en évidence.
Interférences.
Q49 - Dessiner la figure observée sur l’écran.
L’écran peut être remplacé par une webcam, le traitement et l’analyse d’images se feront alors
par l’intermédiaire du logiciel SalsaJ©
(logiciel Open source/Windows). Le fichier image est
enregistré par la webcam dans un format compatible.
Q50 - Donner les extensions de fichiers qui peuvent correspondre à un fichier image.
.jpeg ; .png ; jpg.
Q51 - Donner la signification des lettres dans ExAO.
expérience assistée par ordinateur.
Q52 - Identifier le système d’exploitation nécessaire pour utiliser SalsaJ© et en nommer un
autre.
Windows, Linux , Mac os X.
L’interfrange (i) est la distance entre deux franges consécutives de même intensité lumineuse.
Dans le cas des trous d’Young, elle répond à l’expression suivante : i = l D /a
avec toutes les grandeurs en m.
Q53 - Sachant que 10i = 17 mm, en déduire la distance a séparant les deux trous. Expliquer
pourquoi il est préférable de mesurer 10i.
En mesurant 10i on obtient une meilleurs précision sur la valeur de l'interfrange.
a = l D / i =650 10-9 x0,80 / (1,7 10-3)=3,1 10-4 m.
Q54 - Expliquer comment va évoluer la valeur de l’interfrange si l’expérience est réalisée avec
un laser de couleur bleue.
La longueur d'onde du bleu est inférieure à celle du rouge. l'interfrange diminue.
Le circuit RC.
Q55 - Nommer le matériel.

Q56 - Indiquer trois utilisations possibles de l’appareil 1.
Ampèremètre, voltmètre, ohmmètre.
Q57 - Le premier appareil ne s’allume pas. Indiquer la première chose à vérifier pour essayer
d’identifier la panne de cet appareil.
Vérifier le fusible.
Q58 - Le deuxième appareil mesure des tensions mais ne parvient pas à mesurer des
intensités.
Proposer une cause possible de cette panne.
Le fusible est grillé.
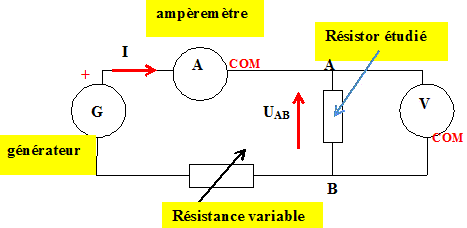
Afin de tester le bon fonctionnement de ces appareils, on les utilise en constituant un circuit
série composé d’un générateur de tension continue E = 12,0V, d’une résistance variable Rv
et d’une résistance R. On mesure la tension UAB aux bornes du conducteur ohmique et
l’intensité du courant I circulant dans le circuit, à l’aide de deux multimètres. On note URv la
tension aux bornes de la résistance Rv. Les différentes valeurs sont reportées dans un tableur
pour une exploitation informatique des données.
Q59 - Schématiser le circuit en plaçant les deux appareils de mesure.
Q60 - Lors de la mise sous tension du montage, l’ampèremètre affiche une valeur négative.
Indiquer ce qu'il faut faire pour que la valeur soit positive.
Permutter les branchements afin que la borne COM soit du côté de la borne négative du générateur.
Q61 - Indiquer deux extensions qui peuvent correspondre à un fichier de type tableur.
xls ; ods.
Le condensateur est un
condensateur dont la capacité affichée
est de 100μF ± 20% et le conducteur
ohmique a une résistance affichée de
1kΩ ± 5%.
Le circuit schématisé ci-contre permet
d’effectuer la charge, puis la décharge
du condensateur.

Q62 - Donner les encadrements des valeurs que peuvent prendre la capacité du condensateur
et la résistance du conducteur ohmique.
100 x0,2 = 20 : [ 80 : 120 µF].
1000 x0,05=50 ohms : [950 ; 1050 ohms].
Q63 - Expliquer comment obtenir la charge, puis la décharge du condensateur à l’aide du
montage.
Charge : interrupteur en position1 ; décharge : interrupteur en position 2.
Pour des constantes de temps inférieures à 1 seconde, l’observation de la charge et de la
décharge est plus aisée en utilisant un oscilloscope. On utilise alors comme source de tension
une sortie particulière du GBF appelée sortie TTL. Le GBF délivre alors une tension créneau
entre 0 et 5V, seule la fréquence de cette tension est réglable.
Il est également possible d’utiliser le GBF avec la sortie principale, en choisissant un type de
signal créneau et en réglant l’OFFSET.
Q64 - Donner la signification des lettres GBF.
Générateur basse fréquence.
Q65 - Expliquer ce qu’est l’OFFSET.
L'OFFSET décale la tension.
Q66 - Compléter.

Q67 - Faire apparaître une période T sur l’oscillogramme.
Q68 - Déterminer le plus précisément possible la période T de ce signal. Expliquer votre
démarche.

2T = 10 x200 = 2000 ; T = 1000 µs = 1 ms.
Q69 - En déduire la fréquence de ce signal.
f = 1 / T =1 / 10-3 = 1000 Hz.
Q70 - Indiquer si le GBF est bien réglé. Si non, expliquer les réglages à effectuer.
Q71 - Indiquer ce qu’est un microcontrôleur.
C'est un circuit intégré qui rassemble les éléments essentiels d'un ordinateur.
Q72 -Indiquer ce qu’est « Python ».
Un langage de programmation open source.
|
|