....
|
Techniques analytiques (45 points)
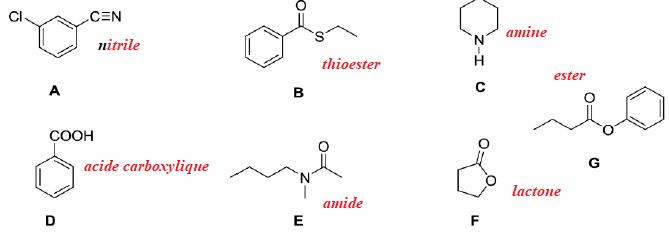
1. Quelle(s)
technique(s) d’analyse permettrai(ent) de différencier les composés A
et B ? Justifier pour chaque méthode (1 point)

Analyse élémentaire : non, ils ont la même formule brute.
Spectrométrie de masse : non.
RMN 1H : oui. B : il existe un doublet correspondant au méthyle en alpha du carbone asymétrique.
Polarimétrie : oui, seul B possède un atome de carbone asymétrique.
RMN 13C : oui. A et B ont de squelettes carbonés différents.
Diffractions des rayons X : non, les strucrures de A et B ne sont pas cristallisées.
Chromatographie.
2. Citer 3 types de
détecteurs pour une HPLC. (1 point)
Réfractomètre ; spectromètre de masse ; conductimètre.
3. Quel type de
colonne est utilisé en HPLC lorsque l’on travaille en phase inverse ?
en phase normale ? (1 point)
- phase normale :
gel de silice polaire ; on utilise un éluant apolaire ; les produits
polaires sont retenus dans la colonne, les produits apolaires sortent
en premiers.
- phase inverse : phase fixe apolaire ; éluant polaire ; les molécules polaires sortent en premier.
4. Que signifie
DEDL ? Décrivez son principe. (1 point)
Détecteur évaporatif à diffusion de lumière intégré.
Détection des solutés sous forme liquide ou solide après une étape d'évaporation.
Etape 1 : nébulisation de la phase mobile ; étape 2 : évaporation de la
phase mobile ; étape 3 : détection grâce à la diffusion de la lumière.
5. Citer deux
solvants pouvant être utilisés comme phase mobile en phase inverse et
les classer par ordre de polarité croissante. (1 point)
Du plus polaire au moins polaire : eau, méthanol, acétonitrile, isopropanol.
6. Que signifie «
travailler en mode gradient » ? Donner un exemple dans le cas d’une
analyse en phase normale. (1 point)
La composition de la phase mobile est modifiée en cours d'analyse.
7. Sur une chaine
HPLC fonctionnant en mode isocratique, la pression oscille. Quelle peut
être la cause et comment résolvez-vous cela ? (1 point)
8. La pression de
votre chaine HPLC est anormalement élevée. Quelle peut être la cause et
comment résolvez-vous cela ? (1 point)
9. Nommer les 8
éléments du montage HPLC ci-dessous (1 point)
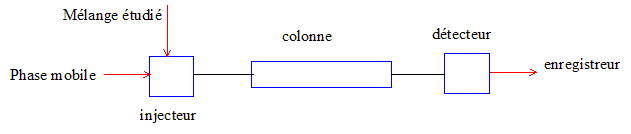
10. Quels avantages
présente l’utilisation de la chromatographie liquide haute performance
par rapport à la chromatographie sur colonne ? Pourquoi utiliser les
particules de petite taille dans la colonne ? (1 point)
HPLC : permet d'identifier, de séparer et de doser des composés chimiques ( même à l'état de traces ) dans un mélange.
Plus la taille des particules est petite, meilleure sera la résolution.
11. Définir le
temps de rétention et de quels paramètres dépend-il ? (1 point)
Temps que met le soluté à sortir de la colonne. Il varie en fonction du
débit, de la température d'élution de la composition de la phase mobile.
12. Dans la
chromatographie en phase inverse, comment varie le temps de rétention
d’une composante du mélange avec la polarité de ses molécules ? (1
point)
Colonne apolaire, phase liquide polaire : le temps de rétention
est d'autant plus court que la composante du mélange est plus polaire.
13. Le diagramme
ci-dessous montre un résultat simplifié sur le détecteur, avec les pics
pour deux composés X et Y. Qu’est-ce qu’on peut dire à propos des concentrations relatives
de X et d’Y dans le mélange ? Justifiez. (1 point)
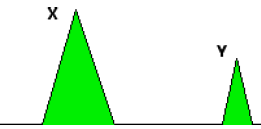
L'aire des pics est proportionnelle à la concentration relative du produit injecté.
L'aire du grand pic est environ égale à 4 fois celle du petit ; la
concentration de X est environ 4 fois plus grande que celle de Y.
14. Le diagramme
ci-dessous montre un pic pour le même composé enregistré lors de deux
mesures différentes. Qu’est-ce qu’on peut dire à propos des concentrations de
solutions du composé lors de chacune de ces mesures ? Justifiez. (1 point)
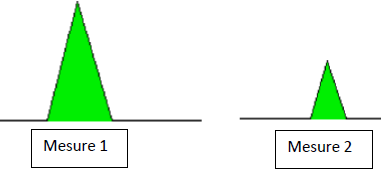
Rapport des aires ~ 4 ; rapport des concentrations ~ 4.
Spectrométrie de Masse.
15. Citer 3 sources
d’ionisation et donner les types d’ions obtenus pour chacune. (1 point)
16. Décrire le
principe de l’une d’entre elles. Vous pouvez vous aider d’un schéma. (1
point)
Electrospray : dispersion d’un liquide sous forme de gouttelettes chargées électriquement.
Les
goutellettes formées à l'extrémité d'un capillaire sont soumises à
un champ électrique intense. On obtient des ions multichargés.
Bombardement atomique
: bombardement des molécules par des atomes ' Ar ou Xe) rapides. Les
molécules ionosées ont une faible énergie interne et l'ion moléculaire
est facile à reconnaître.
Ionisation MALDI : l"échantillon est irradié par un faisceau laser. Génération d'ion à une seule charge.
17. Citer 3 types
d’analyseurs, décrire leur principe (à l’aide d’un schéma si besoin) et
préciser s’ils permettent de faire de la haute ou de la basse
résolution. (1 point)
L'analyseur épare les ions produits en fonction du rapport masse / charge ( m / z).
Analyseur quadripolaire : résolution unitaire sur toute la gamme de masse.
Analyseur à temps de vol : en mode réflectron, la résolution est améliorée.
Séparation des ions en fonction de leur vitesse dans une zone libre de champ.
Analyseur à résonance cyclotronique : très grande résolution.
18. Quel est l’allure du massif isotopique d’un composé de formule brute CxHyCl ? Justifier. (1 point)
Isotopes du chlore 35Cl(75 %) et 37 Cl (25%); pic à M et pic à M+2.
19. Que pouvez-vous déduire de la formule brute d’un ion M+ ayant une masse impaire ? (1 point)
La masse molaire d'une molécule organique qui contient C, H, N, O, Si,
S, F, Cl, Br est toujours paire ( ion moléculaire pair), sauf si elle
contient un nombre impair d'atome d'azote.
20. En travaillant en ESI+, un ion ayant la valeur M+23 est observé. A quoi correspond-il ?
Spectrométrie infra-rouge.
Un extrait du spectre infrarouge de l’hexan-2-ol est donné ci-dessous.
21. Donner le principe de la spectrométrie infra-rouge. (1 point)
Dans une molécule, les liaisons chimiques peuvent être décrites comme des ressorts liant les atomes.
Lorsqu’une molécule absorbe de l’énergie sous la forme d’un rayonnement
infrarouge, les atomes se mettent à vibrer. Ils entrent alors en
oscillation.
Lorsqu’une longueur d’onde l correspond
à la fréquence d’excitation d’une liaison chimique, l’énergie du
rayonnement est absorbée par la molécule. La mesure de l’intensité de
lumière absorbée à chaque longueur l conduit
à un spectre caractéristique du produit étudié ; ce spectre présentant
des bandes d’absorption correspondant à l’excitation de certaines
liaisons chimiques.
22. Quels états de la matière peut-on analyser par spectrométrie infra-rouge ? (1 point)
Solide (échantillon mélangé avec KBr), liquide ( placé entre deux plaque d'un sel très pur NaCl), gazeux.
23. Ecrire la
formule semi-développée de l’hexan-2-ol. En déduire le groupe
caractéristique et la fonction chimique de ce composé. (1 point)
H3C-CH2-CH2-CH2-CH(OH)-CH3. Alcool secondaire.
24. Identifier alors les bandes d’adsorption notées (a), (b), (c) et (d). (1 point)
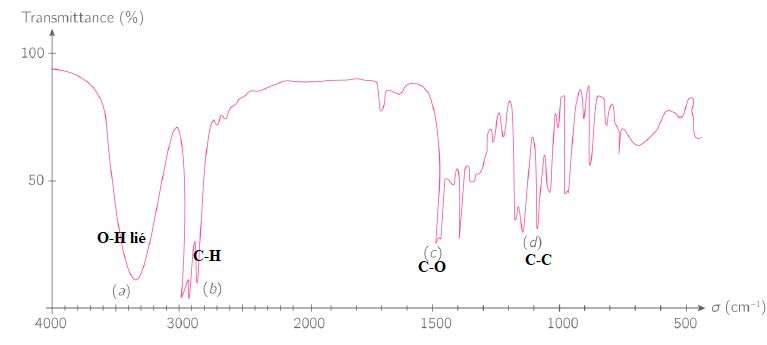
RMN.
25. Quelle opération mathématique permet d’obtenir un spectre à partir de la FID ? (1 point)
Transformation de Fourier.
26. Pourquoi utilise-t-on des solvants deutérés ? (1 point)
Ils solubilisent le produit à analyser sans donner de signal.
27. A quoi sert le tétraméthylsilane (TMS) ? (1 point)
Référence, étalonnage interne des déplacement chimiques.
28. Citer les deux liquides cryogéniques utilisés pour l’aimant supraconducteur d’un spectromètre RMN. (1 point)
Héliulm liquide, azote liquide.
Exercice.
Voici les spectres IR et RMN du 1H enregistrés de la molécule C5H8O.
29. Quelle information donne la multiplicité d'un signal RMN ? (1 point)
Détermine le nombre n de protons ou groupes de protons voisins du groupe considéré au sein de la molécule.
30. Donner la formule développée de la molécule.
d(ppm) = 9,40, singulet, un proton, pas de proche voisin. C-H aldehyde.
d(ppm) = 6,62, quadruplet, un proton, trois proches voisins.
d(ppm) = 1,99, doublet, 3 protons, un proche voisin.
d(ppm) = 1,75, singulet, 3 protons, pas de proche voisin.
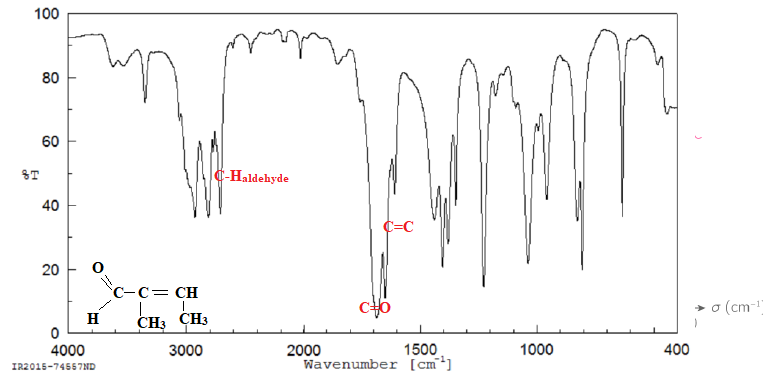
Diffraction des rayons X (DRX).
31. Quel est le principe de la DRX ? (1 point)
Diffraction des rayons X sur un échantillon solide plat ou sur une
poudre lorsque le solide est cristallisé. La diffraction se fait
suivant les plans cristallins. Ces faisceaux diffractés interfèrent
entre eux, donnant un signal intense dans certaines zones de l'espace..
32. Comment s’effectue une mesure de DRX ? (1 point)
L'échantillon est sous forme d'une poudre applatie dans une coupelle ou
sous forme d'une plaquette solide. Cet échantillon reçoit des rayons X.
Un détecteur fait le tour de l'échantillon afin de mesurer l'intensité
des rayons X selon la direction.
33. Quels sont les
3 états cristallins de la matière ? Parmi les trois, lequel ou lesquels
sont adaptés aux mesures de la diffraction ? Pourquoi ? (1 point)
Monocristaux :gaces planes se coupant selon des arêtes vives, les angles sont bien déterminés.
Agrégats d'une multitudes de cristaux.
34. Quelles informations sur des matériaux peut-on obtenir à partir de mesures de DRX ? (1 point)
Distance des atomes, distances entre plans intracristallins.
Nature des phases cristallines présentes.
35. Quel genre de préparation peuvent nécessiter des échantillons pour une mesure de la DRX ? (1 point)
On prépare l'échantillon sous forme d'une poudre aplatie dans une coupelle ou bien sous forme d'une plaquette solide plate.
36. Rappeler la relation de Bragg en indiquant à quoi correspond chaque grandeur. (1 point)
2 d sin q = n l.
d : distance inter réticulaire ; l longueur d'onde de la radiation , q directions de l'espace dans lesquelles on a des pics d'intensité.
37. Le diagramme de
diffraction des rayons X de Fe cubique est présenté sur la figure
ci-dessous. Les positions exactes de pics de diffraction sont
présentées sur le graphe pour la longueur d’onde l = 1,54 Å. Calculer la distance inter-réticulaire correspondant au plan (002) et le paramètre de maille de fer.
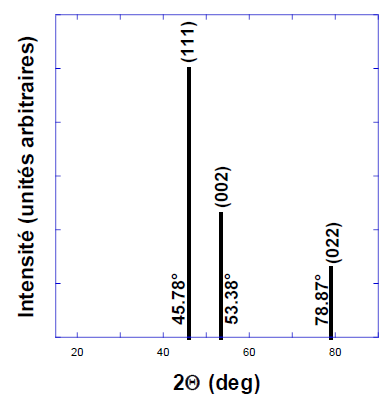
Pour n = 1 : d =1,54 10-10 / (2 xsin 53,38 )=9,6 10-11 m.
d = a / (02 +02 +22)½ = a / 2 .
Paramètre de la maille a = 2d = 1,92 10-10 m.
Concepts de qualité appliqués aux techniques d'analyse chimique.
38. Décrivez en quelques lignes la fonction d’un cahier de laboratoire. (1 point)
Détails précis de tous les travaux effectués ; dates de ces travaux.
39. A quelle périodicité doit-il être rempli ? (1 point)
Tous les travaux doivent être enregistrés au jour le jour.
40. Si vous quittez le laboratoire, à qui appartient le cahier ? (1 point)
Le cahier de laboratoire d'un technicien appartient à son entreprise.
41. Qu’est-ce que la métrologie ? (1 point)
La métrologie est la science de la mesure ; elle définit les principes et les méthodes.
42. En quoi consiste la qualification des performances d’un appareil ? (1 point)
Vérification documentée prouvant que l'appareil donne des résultats justes et reproductibles.
43. Citer 3 tests à effectuer pour qualifier une chaine HPLC équipée d’un détecteur UV. (1 point)
Injecteur :répétabilité du volume injecté, linéarité du volume injecté,
justesse et linéarité de la température de l'autosampler, test de
fonctionnement de la pompe, test de pression.
Détecteur UV : vérification de l'énergie de la lampe, exactitude des longueurs d'onde.
44. Donner une définition de la justesse d’un résultat. Vous pouvez vous aider d’un schéma. (1 point)
Etroitesse de l'accord entre une mesure et la valeur conventionnellement vraie de l'échantillon.
45. Que peut-on dire d’un appareil qui est précis ? Vous pouvez vous aider d’un schéma. (1 point)
Un appareil de mesure est prècis si l'écart entre deux graduations est petit.
Hygiène et sécurité (15 points)
1. Que signifient les acronymes suivants ? (1 point)
FDS : fiche de données de sécurité.
EPI : équipement de protection individuelle.
CMR : cancèrigène, mutagène, reprotoxique.
2. Vous devez
éliminer les produits listés dans le tableau ci-dessous, dans quels
bidons étiquetés doivent-ils être placés ? Relier les produits aux
bidons appropriés. (1 point)
Tétrahydrofurane : solvant non halogéné.
Dichlorométhane : solvant halogéné.
Hydroxyde de sodium : solutions basiques.
Acide sulfurique : solutions acides minéraux.
3. Citer au moins 6 informations que l’on trouver dans une fiche de sécurité d’un produit chimique ? (2 points)
Propriétés physiques ( température de fusion, température d'ébullition,
point d'éclair ), toxicité, effets sur la santé, mesures d'aide
d'urgence, réactivité, stockage, élilination, équipement de protection
nécessaire, mesures à prendre en cas d'urgence.
4. Citer 3 précautions de stockage de produits chimiques ? (1,5 points)
Limiter l'accès au stock aux personnes formées et autorisées.
Tenir à jour l'état du stock.
Existence de la fiche de données de sécurité et de l'étiquetage du produit.
Gestion du stock de produits.
L’ensemble des chercheurs et ingénieurs du laboratoire utilise 43 g
d’un produit chimique par semaine. On souhaite constituer un stock de
sorte à disposer de ce produit en ayant 4 mois d’avance. Le produit est
vendu en flacon de 110 g au prix de 234 Euros l’unité. (Considérer que
1 an contient 52 semaines)
5. Combien de flacons doit-on commander pour approvisionner le stock ? Détaillez le calcul. (1,5 points).
4 mois ~18 semaines ; 43 x18 =774 g ; 774 / 110 ~7 flacons.
6. Quel est le montant du budget consacré à l’achat de ce produit sur 2 ans ? Détaillez le calcul. (1,5 points)
43 x52 x2 =4472 g soit 4472 / 110 ~ 41 flacons.
41 x 234 =9594 €.
7. Quels moyens peuvent être mis en oeuvre pour gérer efficacement l’approvisionnement du stock des produits chimiques ? (1 point)
Optimiser les achats en améliorant la visibilité et données en temps
réel, le reporting ( communications des données ) et l'automatisation.
Risques liés à la manipulation de produits chimiques (pictogrammes)
8. Compléter le tableau suivant (2,5 points).
pictogramme
|
signification
|
symptômes, risques
|
consignes de sécurité
|
|

|
cancérogène, mutagène, reprotoxique
|
modification du fonctionnement de l'organisme
|
port de gants, lunette, blouse, travail sous hotte aspirante
|
|

|
Danger pour l'environnement
|
polluant
|
ne pas jeté dans les eaux usées, récupération après utilisation |
|

|
Gaz , liquide sous pression
|
risque d'explosion sous l'effet des sources de chaleur
|
port de gants, lunette, blouse, |
|

|
Comburants
|
facilite les combustions
|
tenir éloigné des substances inflammables
|
|

|
Corrosif
|
ronge les métaux, la peau, les yeux
|
port de gants, lunette, blouse, |
|
9. Citer deux risques liés à la manipulation d'azote liquide.
Brûlures de la peau, graves dommages pour les yeux.
Asphyxie si la teneur en oxygène de la salle de manipulation est inférieure à 18 %.
10. Citer 4
exemples de protection individuelle et 4 exemples de protection
collective lors de la manipulation des produits chimiques.
Protections individuelles : gants, lunettes ou écran facial, vêtement
de protection, appareil de protection respiratoire, chaussures de
sécurité.
Protections collectives : postes de sécurité microbiologiques.
Sorbonnes pour la protection contre le risque chimique, pour les produits volatils toxiques par inhalation
Ventilation correcte des locaux.
Conteneurs adaptés pour les produits souillés.
Stockage réglementaire des produits dangereux.
Signalisations des zones où sont manipulés des agents biologiques ou des radioéléments.
Environnement, métier (5 points).
1. Que signifie CNRS ?
Centre national de la recheche scientifique.
2. A quelle catégorie de la fonction publique appartient le corps des assistants d'ingénieurs ?
Corps de catégorie A.
3. Quels autres corps peut-on trouver dans l'enseignement supérieur et la recherche ?
Doctorant ; enseignants-chercheurs, maître de conférence et professeur d'université ; chercheurs ; ingénieurs de recherche.
Technicien de recherche et de formation ; adjoint technique de recherche et de formation.
4. Que signifient les acronymes suivants ?
BAP : branche d'activités professionnelles; UMR :unité mixte de
recherche ; ITRF : ingénieur et personnel technique de recherche
et de formation.
...
|