Physique
chimie, concours Puissance alpha 2022.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
.
.
|
..
..
......
...
|
Exercice 22 : Interférences lumineuses.
Un élève réalise une expérience d’interférences en éclairant deux fentes d’Young (deux fentes fines identiques
verticales et parallèles) avec une source ponctuelle monochromatique de longueur d’onde 600 nm placée
en S sur l’axe de symétrie du système. Les milieux des deux fentes S1 et S2 sont séparés d’une distance a.
La figure d’interférences (ci-dessous) est observée sur un écran situé à la distance D=1,5 m des fentes.
Pour effectuer une mesure précise de l’interfrange i, l’élève mesure la distance L= 3,6 cm correspondant à 12 interfranges.
a) Dans cette expérience, la distance séparant les deux fentes d’Young vaut a = 0,30 mm. Vrai.
i = L / 12 = 36 / 12 = 3 mm.
i = l D / a ; a = l D / i = 600 10-9 x1,5 / (3 10-3) =3 10-4 m = 0,30 mm.
.
b) Sachant que la différence de marche au point A vaut d = 1,8 µ𝑚, les
ondes interfèrent, en ce point A, de manière constructive.Vrai.
d / l =1,8 10-6 /( 600 10-9) =3.
L’élève s’intéresse au point B sur l’écran. Il mesure la distance séparant le point B du centre O de la figure
d’interférences et obtient OB= 4,5 cm.
c) Au point B, les ondes issues des fentes S1 et S2 arrivent en opposition de phase. Faux.
OB / i = 45 / 3 = 15.
B est au centre d'une frange brillante. Les ondes issues des fentes S1 et S2 arrivent en phase..
d) Avec deux sources lasers identiques orientées vers le point B, on n’observe pas le même résultat
qu’avec le dispositif (source S + fentes d’Young). Vrai.
Les deux lasers ne sont pas des sources de lumières cohérentes, condition nécessaire pour obtenir des interférences..
Exercice 23 : échange au volley ball .
Au cours d’une séance d’entrainement, un joueur de volley ball frappe le ballon, de 21 cm de diamètre, alors
que le centre d’inertie de ce dernier se trouve à une hauteur de h = 2,0 m du sol. Il lui communique une
vitesse v1 représentée sur le schéma ci-dessous. Au même moment, située à 1,0 m du filet, la défenseuse
adverse qui a anticipé l’action, prend une impulsion et s’élève verticalement, avec une vitesse initiale v2 =
4,0 m / s. On supposera qu’avant le saut, son centre d’inertie se situe à 1,0 m du sol.
On négligera toute action de l’air. g = 10,0 m s-2.
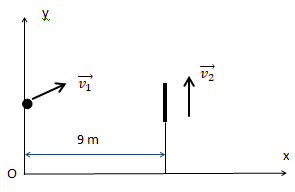
a) Après avoir quitté la main du volleyeur, le ballon a un mouvement de chute libre.Vrai.
Le ballon n'est soumis qu'à son poids ( action de l'air négligée).
b) Le mouvement est accéléré le long de l’axe Ox. Faux.
Le poids étant vertical, la seconde loi de Newton s'écrit selon OX : ax = 0.
Vitesse selon Ox : vx = constante.
Les équations horaires du ballon sont : x(t) = 20 t ; y(t) = -5,0 t2+4,5 t +2,0.
L’équation de sa trajectoire est : y(x) = − 0,0125 x2 + 0,225 x + 2,0.
c) Lorsque le ballon arrive au niveau de la défenseuse adverse, son centre d’inertie se situe à 3,0 𝑚
du sol. Vrai.
x = 10 ; y =-0,0125 * 100 +0,225 x10 +2,0 = -1,25 +2,25 +2 = 3,0 m
d) La défenseuse, ayant toujours l’extrémité de ses doigts 1,0 m au dessus de son centre d’inertie,
réussit à intercepter le ballon.
Faux.
Abscisse du ballon : x = 10 = 20 t ; t =0,5 s.
Doigts de la défenseuse : y = -5t2 +v2t+2 = -5t2 + 4t+2 =-5 *0,25 + 4 = 2,75 m.
Rayon du ballon :0,105 m.
2,75 +0,105 < 3,0.
Excecice 24 : bilan d'énergie thermique.
On souhaite construire un mur extérieur d’une maison en brique. Il sera sans ouverture (sans porte ni fenêtre).
L’aire de sa surface doit être égale à 60 m2. Sans isolation, il est prévu que l’épaisseur de brique soit de
20 cm.
La température intérieure de la maison sera maintenue constante à 20°C grâce à un chauffage électrique qui
doit compenser le flux thermique à travers le mur. On se place dans la situation où la température extérieure
est de 0°C. On note par ailleurs que 1 kWh d’énergie électrique fournie par EDF coûte environ 0,10 €.
On souhaite isoler le mur pour diminuer les déperditions thermiques. Pour cela, on considère deux techniques
d’isolation :
1
ère technique : on accole au mur en brique de 20 cm une épaisseur de polystyrène de 4,0 cm.
2
ème technique : Le mur est construit avec deux parois de briques de 10 cm chacune, séparées par une
couche d’air de 4 cm.
a) La résistance thermique du mur en brique sans isolation est de 5 × 10−3 K W−1. Vrai.
lbrique = 0,67 W m-1 K-1.
Résistance thermique Rth = e / (l S) =0,20 /(0,67 *60) ~ 5 × 10−3 K W−1.
b) Sans isolation, dans les conditions évoquées dans l’énoncé, il faudra payer à EDF environ 6 € par
jour pour compenser la perte d’énergie à travers ce mur. Faux.
Flux thermique à travers le mur : DT / RTh =20 / (5 10-3) = 4,0 103 W.
Energie correspondante :4 103 x 24 =96 103 Wh = 96 kWh.
Dépense journalière : 96 x 0,10 =9,6 €.
c) La résistance thermique du mur isolé selon la première technique d’isolation (avec le polystyrène)
sera égale à 2,5 × 10−2 K W−1
. Vrai.
lpoly = 0,033 W m-1 K-1.
Rth = ebrique / (lbrique S) + epoly / (lpoly S)=0,20 /(0,67 *60) +0,04 /(0,033 x60)~ 5 × 10−3 + 2 10-2 ~2,5 10-2 K W−1.
d) La première technique d’isolation est plus efficace que la seconde. Faux.
lair = 0,025 W m-1 K-1.
Rth = ebrique / (lbrique S) + eair / (lair S)=0,20 /(0,67 *60) +0,04 /(0,025 x60)~ 5 × 10−3 + 2,7 10-2 ~3,2 10-2 K W−1.
Exercice 25. La planète Mars.
La planète Mars est la quatrième planète la plus proche du Soleil. Elle présente un diamètre de 6800 km
environ et effectue une révolution autour du Soleil en 687 jours, soit approximativement 2 ans. La planète
rouge tourne sur elle-même en 24h 37 min et sa masse est trois millions de fois plus faible que celle du Soleil.
On rappelle que la période de révolution T d’une planète, décrivant une orbite de demi grand axe a autour
du Soleil vérifie la loi de Kepler
T2 / a3 = 4 p2 / (GMS) où MS
est la masse du Soleil.
Masse de la Terre : 6 × 1024𝑘𝑔 . Distance Terre-Soleil : 1,5 × 1011𝑚 = 1 unité astronomique (ua)
- Période de révolution de la Terre : 1 an ≈ 3 × 107
𝑠 . Constante universelle de gravitation : 𝐺 = 7 × 10−11 𝑁. 𝑚2
. 𝑘𝑔−2 .
1,62 = 2,6 ; 1,6
3 = 4 ; 1,52 = 2,25 ; 1,5× 1,6 = 2,4 ; 1,5
3 = 3,4 ; p = 3.
a) D’après la deuxième loi de Kepler, le rayon soleil-planète balaie des aires égales pendant des durées
égales à certaines positions bien précises sur l’orbite. Faux.
b) Si l’on considère la trajectoire de Mars dans le référentiel héliocentrique comme circulaire, le rayon
de son orbite vaut environ 2,4 × 1011 𝑚. Vrai.
T2mars / a3mars = T2terre / a3terre ; a3mars = T2mars / T2terre a3terre = (687 / 365)2 x13 =3,54 u.a3.
amars =1,5 ua =1,5 x 1,5 1011 ~2,4 1011 m.
c) La masse de Mars vaut environ 2 × 1030 kg. Faux.
T2terre / a3terre = (3,7107)2 / (1,5 1011)3 =4 10-19.
4 10-19 =4 p2 / (GMS) ; MS= 32 /(10-19 x7 10-11)~1,3 1030 kg.
masse de mars : 1,3 1030 /( 3 106)~4 1023 kg.
d) Une planète située quatre fois plus loin du Soleil que Mars, aurait une période de révolution d’environ
16 ans.
T2 / a3 = constante. Vrai.
Si a est multiplié par 4, a3 est multiplié par 64 et T est multiplié par 8.
687 / 365 ~1,9 ans ; 1,9 x 8 ~ 16 ans.
|
....
|
Exercice 26. Etude cinétique par spectrophotométrie.
Le diode dispose de propriétés antiseptiques mises à profit pour désinfecter des plaies ou brûlures
superficielles, on le retrouve ainsi dans l’eau iodée ou dans la bétadine.
On se propose ici d’étudier la cinétique de la réaction permettant de former du diiode I2 à partir des ions
iodure I- et des ions peroxodisulfate 𝑆2𝑂8
2− à l’aide d’un suivi par spectrophotométrie.
L’équation de la réaction modélisant cette transformation totale est :
2𝐼
−(aq) + 𝑆2𝑂8
2−(𝑎𝑞) --> 𝐼2
(𝑎𝑞) + 2𝑆𝑂4
2−(𝑎𝑞).
Le diiode est la seule espèce colorée.
A l’instant initial, on réalise un mélange à partir d’un volume 𝑉1 = 10,0 mL de solution d’iodure de
potassium ( 𝐾
+(𝑎𝑞) + 𝐼
−(aq) ) de concentration 𝐶1 = 5,0 × 10−1𝑚𝑜𝑙. 𝐿
−1
et d’un volume 𝑉2 =
10,0 𝑚𝐿 de solution de peroxodisulfate de sodium (2𝑁𝑎+(𝑎𝑞) + 𝑆2𝑂8
2−(𝑎𝑞)) de concentration 𝐶2 =
4,0 × 10−3𝑚𝑜𝑙. 𝐿
−1
.
La longueur d’onde du spectrophotomètre est réglée sur la valeur correspondant à l’absorption maximale par
le diiode. La loi de Beer Lambert nous permet d’écrire ici : 𝐴 = 400 × [𝐼2
] 𝑎𝑣𝑒𝑐 [𝐼2
] 𝑒𝑛 𝑚𝑜𝑙. 𝐿
−1
.
On obtient la courbe ci-dessous :
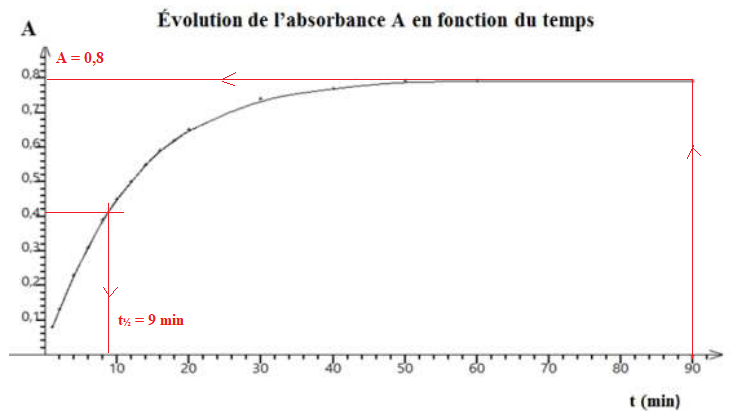
a) La réaction qui se produit est une réaction d’oxydoréduction. Vrai.
Oxydation de I- : 2I- --> I2+2e-.
Réduction de 𝑆2𝑂8
2− : 𝑆2𝑂8
2−(𝑎𝑞)+2e- --> 2𝑆𝑂4
2−(𝑎𝑞).
b) La quantité de diiode produite après 90 𝑚𝑖𝑛 vaut environ 40 𝑚𝑚𝑜𝑙. Faux.
[I2] = A / 400 = 0,8 / 400 =0,002 mol / L = 2 mmol / L dans un volume de 20 mL
Soit 2 x20 / 1000 =0,04 mmol.
c) Le temps de demi-réaction vaut environ 30 𝑚𝑖𝑛. Faux.
d) En utilisant une solution d’iodure de potassium plus concentrée, on formera davantage de diiode à la
fin de la transformation. Faux.
Quantité de matière initiale : n(I2 ) =C1V1 = 0,5 x 10 = 5 mmol.
n(𝑆2𝑂8
2− ) =C2V2 = 4 10-3 x 10 = 0,04 mmol.
n(𝑆2𝑂8
2− ) / 1 =0,04 mmol ; n(I2 ) / 2 = 2,5 mmol ( en excès).
Exercice 27. Aspirine 500.
L’aspirine est un médicament antipyrétique, anti-inflammatoire et analgésique. Il est
également utilisé, sous faible dosage, pour ses propriétés anticoagulantes. Son principe
actif est l’acide acétylsalicylique, dont la molécule est représentée ci-dessous.
Il fait partie d’un couple acide/base qui sera représenté dans la suite de l’exercice par
𝐴𝐻/𝐴
−.
Le technicien « qualité » d’une firme pharmaceutique est chargé de
contrôler la qualité du produit synthétisé
par son entreprise et doit en particulier vérifier l’indication «
Aspirine 500 ». Pour cela, il broye un comprimé
d’aspirine 500 qu’il dissout ensuite dans un volume 𝑉 d'eau distillée.
Puis il réalise un titrage suivi par pHmètrie de la solution S obtenue
par une solution d’hydroxyde de sodium (𝑁𝑎+(𝑎𝑞) + 𝐻𝑂
−(𝑎𝑞)) ) de
concentration en soluté apporté 𝐶𝑏 = 2,0 × 10−1 𝑚𝑜𝑙. 𝐿
−1
.
L’équation de la réaction support du titrage est : 𝐴𝐻(𝑎𝑞) + 𝐻𝑂
−(𝑎𝑞) --> 𝐴
−(𝑎𝑞) +
𝐻2𝑂(𝑙)
Ci-dessous, quelques informations portées sur la boite du médicament :
Principe actif acide acétylsalicylique 500 mg par comprimé.
Excipients amidon de maïs, poudre de cellulose granulée.
- Masse molaire de l’aspirine : 𝑀(𝑎𝑠𝑝𝑖𝑟𝑖𝑛𝑒) = 180 g.mol-1
- Solubilité de l’aspirine dans l’eau à 25°C : 𝑠 = 3,3 𝑔. 𝐿
−1.
Le technicien obtient l’une des courbes suivantes :
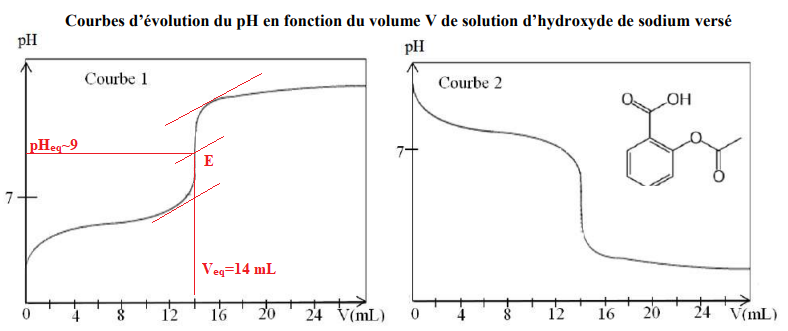
a) Le technicien peut utiliser une fiole jaugée de 100 𝑚𝐿 pour effectuer sa dissolution. Faux.
Solubilité 3,3 g / L soit 0,33 g= 330 mg dans 100 mL.
b) Le technicien obtient la courbe 2. Faux.
.
c) Le technicien choisit la phénolphtaléine (zone de virage 8,2 ; 10 )comme indicateur coloré : l’équivalence est repérée par le
passage de l’incolore au rose. Vrai.
d) Le technicien obtient la même indication que celle indiquée sur la boite à moins de 1% près. Vrai.
Quantité de matière à l'équivalence : Cb Véq =0,20 x 14 = 2,8 mmol.
Masse d'aspirine : 2,8 x 180 = 504 mg.
Ecart relatif : (504-500) / 500 = 0,008 ( 0,8 %).
Exercice 28 : Dosage par conductimétrie.
On souhaite vérifier la concentration en chlorure de sodium d’une dosette de 5,0 mL de sérum physiologique
à l’aide d’un dosage par étalonnage suivi par conductimétrie. Le sérum physiologique étant trop concentré
pour le conductimètre, il est nécessaire au préalable de le diluer 20 fois. On obtient alors une solution appelée
solution S, dont la conductivité vaut s = 1,0 mS. cm−1
.
A l’aide de plusieurs solutions étalons de chlorure de sodium (de concentration connue), on trace la courbe
d’étalonnage suivante :
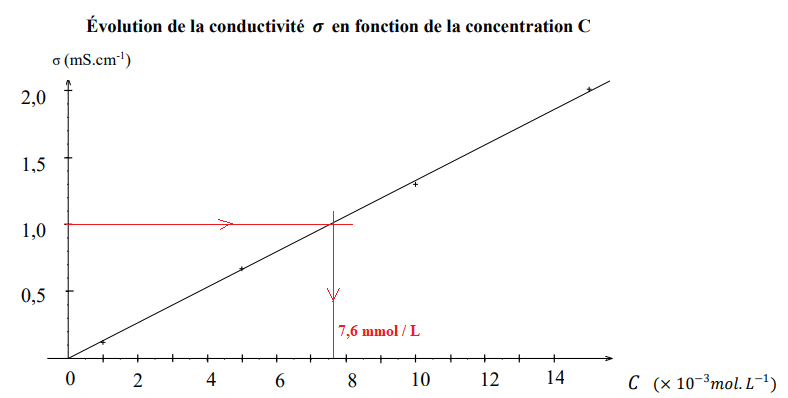
a) La dilution du sérum physiologique contenu dans toute la dosette peut se faire à l’aide d’une fiole
jaugée de 50,0 𝑚𝐿. Faux.
Volume de la fiole jaugée : 20 x volume dosette =20 x 5,0 = 100 mL.
b) La solution S a une conductivité égale à 0,10 𝑆. 𝑚−1
. Vrai.
1,0 10-3 / 10-2 =0,1 S m-1.
c) Il est conseillé de ne plus utiliser le sérum physiologique étudié car sa concentration massique est
inférieure à 8,0 𝑔. 𝐿
−1
. Faux.
C = 7,6 mmol / L ; M(NaCl) = 23 +35;5 = 58,5 g / mol.
7,6 x 58,5 =444,6 mg / L ~ 0,44 g / L.
Tenir compte de la dilution : 20 x 0,4446 ~8,9 g / L
d) La mesure peut être considérée comme satisfaisante. Vrai.
La composition du sérum physiologique est extrêmement simple. Il s’agit d’eau distillée stérile, dans laquelle
du chlorure de sodium (𝑁𝑎𝐶𝑙) a été dissout, à hauteur de 0,9% en masse.
Ecart relatif ( 9 -8,9 ) / 9 ~0,011 ( 1,1 %)
Cette valeur étant inférieure à 5 %, c'est satisfaisant.
|
|