A couleur : pigments et colorants.
Unfournisseur indique une concentration de
colorant " bleu brillant" CI 42090 : (4,0 ±0,2) 10
-6
mol /L.
1. Spectre d'absorption :
couleur et choix de la longueur d'onde.
On donne le spectre d'absorption d'une solution aqueuse de ce colorant.
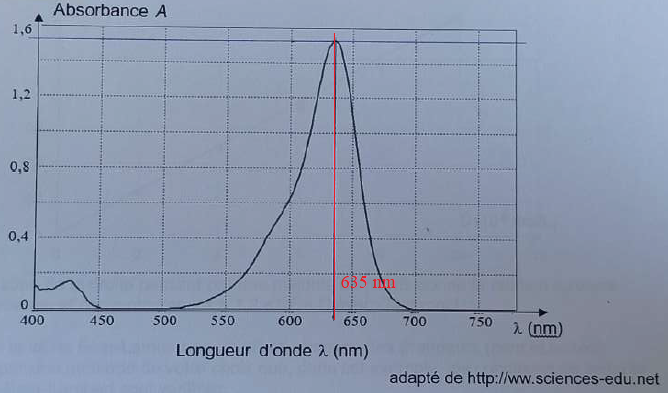 1.
1. Vérifier en
justifiant la couleur de cette solution.
Le maximum d'absorption se situe vers 635 nm ( couleur orange) ; la
solution possède la couleur complémentaire de la colueur orange, c'est
à dire le bleu.
2. A quelle
longueur d'onde faut-il régler le spectrophotomètre ?
Pour un maximum de précision, le spectrophotomètre est réglé sur la
longueur d'onde du maximum d'absorption soit vers 635 nm.
Courbe d'étalonnage.
Une gamme d'étalonnage a été réalisée par dilution d'une solution
aqueuse de ce colorant de concentration 1,0 10
-5 mol / L. On
mesure l'absorption de chaque solution.
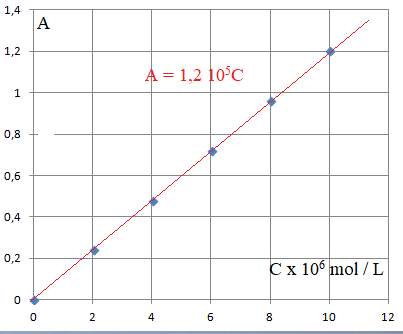 3.
Exprimer la loi de Beer-Lambert en détaillant chacune des grandeurs (
nom et unité).
3.
Exprimer la loi de Beer-Lambert en détaillant chacune des grandeurs (
nom et unité).
A= elc (
A est l'absorbance ou densité
optique)
Cette loi est vérifiée lorsque la solution est de concentration
inférieure à : c < 0,1 mol.L-1.
e (L mol-1 cm-1)
est une caractéristique de la molécule. Plus e sera
grand, plus la solution absorbe.
l est l'épaisseur
de la cuve (cm) et c la concentration de la solution (mol/L).
4. Justifier que
cette loi est vérifiée.
Les points
expérimentaux sont alignés sur une droite passant par l'origine.
L'absorbance est donc proportionnelle à la concentration. La loi est
bien vérifiée.
3. Mesures.
On mesure dans les mêmes conditions l'absorbance de la solution étudiée
; on trouve A = 0,462.
5. Déterminer la
concentration de ce colorant.
C = A / (1,2 10
5) =0,462 / (1,2 10
5) =3,85 10
-6
mol / L.
On estime que l'incertitude relative lors de ce dosage est de 5 %.
6. Exprimer le
résultat de la mesure.
3,85 10
-6 x 5 / 100 ~2 10
-7 = 0,2 10
-6.
C = (3,9 ±0,2) 10
-6 mol / L.
7. L'indication du
fabricant est-elle correcte ?
(4,0 ±0,2) 10-6
mol /L soit [3,8 10-6 ; 4,2 10-6].
Résultat de la mesure : [3,7 10-6 ; 4,1 10-6].
Les deux intervalles se recoupent : l'indication du fabricant est donc
correcte.

