Indigo
et carmin d'indigo, bac Amérique du Nord 2022.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
|
.
.
|
|
. | .
.
|
..
..
......
...
|
Un tissu, daté de 6000 ans, a été retrouvé sur un site archéologique de la côte nord du Pérou. Il
présente d’anciennes traces d’utilisation d’une teinture bleue : l’indigo qui colore aujourd’hui
encore les blue-jeans. L’indigo peut être synthétisé ou extrait d’un arbuste : l’indigotier.
L’objectif de cet exercice est tout d’abord d’étudier la synthèse de l’indigo et le principe de la
teinture d’un tissu, puis de s’intéresser aux propriétés du carmin d’indigo qui peut aussi être extrait
de l’indigotier
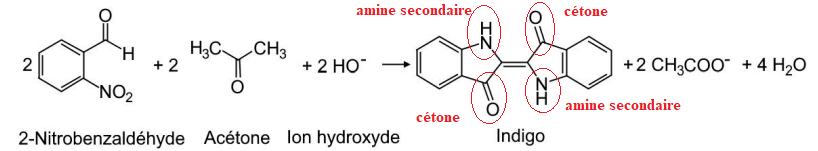
A. Synthèse de l’indigo
L’indigo peut être synthétisé à partir du 2-nitrobenzaldéhyde et de l'acétone selon la
transformation modélisée par l’équation de réaction suivante :
Protocole de la synthèse
- Introduire 0,50 g de 2-nitrobenzaldéhyde dans un erlenmeyer.
- Ajouter 5,0 mL d’acétone puis environ 10 mL d’eau distillée et boucher.
- Utiliser l’agitateur magnétique pour dissoudre totalement le solide.
- Ajouter lentement 5,0 mL de solution d’hydroxyde de sodium à 2,0 mol·L-1 et poursuivre
l’agitation pendant 5 min.
- Filtrer sous vide. Rincer le solide avec de l’eau puis avec de l’éthanol. Sécher le solide.
A.1. Entourer les groupes
caractéristiques sur la formule topologique de l’indigo, et nommer les familles
fonctionnelles correspondantes.
A.2. Déterminer les quantités de matière introduites de 2-nitrobenzaldéhyde et d’acétone.
L’hydroxyde de sodium est introduit en excès.
2-nitrobenzaldéhyde : M = 151,1 g / mol ; n = 0,50 / 151,1 =3,3 10-3 mol = 3,3 mmol.
Acétone : M = 58,1 g / mol ;d = 1,05 ; masse m = 5,0 x1,05 = 5,25 g : n = 5,25 / 58,1 =9,0 10-2 mol = 90 mmol ( en excès)
A.3. En supposant la transformation chimique comme totale, identifier le réactif limitant et en
déduire la masse maximale d’indigo qui peut être obtenue.
Quantité de matière théorique d'indigo : 3,3 mmol.
M'indigo) =262,3 g / mol ; mth = 3,3 10-3 x 262,3 =0,87 g.
Après séchage, la masse de solide obtenue est de 0,35 g.
A.4. Déterminer la valeur du rendement de la synthèse chimique.
Masse réelle / masse théorique =0,35 / 0,87 =0,40 ( 40 %).
B. Teinture d’un tissu par l’indigo
L’indigo, sous sa forme oxydée notée Ind (s), est un colorant solide bleu, insoluble dans l’eau. Il
ne peut imprégner la fibre à teindre que sous sa forme réduite, de couleur jaune pâle, dont la
formule est IndH2 (aq). Pour réduire l’indigo on utilise des ions dithionite S2O4
2-
(aq).
Donnée : demi-équation électronique associée aux ions dithionite S2O4
2-
(aq) + 2 H2O(ℓ) = 2 SO3
2-
(aq) + 4 H
+
(aq) + 2 e
-
B.1. Écrire le couple oxydant-réducteur de l’indigo et la demi-équation électronique associée.
Ind(s) / IndH2(s) : Ind(s) +2H+aq +2e- = IndH2(s) :
B.2. Établir l’équation de la réaction modélisant la transformation prenant place entre l’indigo
et les ions dithionite.
Ajouter les demi-équations puis simplifier :
S2O4
2-
(aq) + 2 H2O(ℓ) + Ind(s) = 2 SO3
2-
(aq) + 2 H
+
(aq) + IndH2(s).
Le tissu imprégné de la forme réduite IndH2 est ensuite exposé à l’air. L’indigo se forme par
oxydation de IndH2 et reste emprisonné dans le tissu pour lui donner sa couleur bleue.
B.3. Nommer l’oxydant mis en jeu dans cette transformation.
Dioxygène de l'air.
C. Le carmin d’indigo, un indicateur coloré acido-basique.
Le carmin d'indigo est un colorant bleu de synthèse (E132) qui imite l’indigo. Le carmin d’indigo
est utilisé comme indicateur coloré acido-basique. On notera HIn sa forme acide et In– sa base
conjuguée. La forme acide est bleue tandis que la forme basique est jaune. On cherche ici à
déterminer la valeur de la constante d'acidité du couple.
On dispose d'une solution commerciale de carmin d’indigo en solution aqueuse. La
concentration en quantité de matière en acide HIn apporté de cette solution est
c = 1,0 × 10-1 mol·L–1
. Après avoir étalonné un pH-mètre, on mesure le pH d'un volume
V = 100,0 mL de la solution commerciale. On trouve un pH égal à 6,3.
Données : couples acide-base : H2O(ℓ )/HO-
(aq) ; H3O+
(aq)/H2O(ℓ).
C.1. Écrire l'équation de la réaction de l'acide HIn avec l'eau.
HIn(aq) + H2O(l) --> In-aq +H3O+aq.
C.2. Déterminer le taux d'avancement final et le relier au caractère total ou non total de la
transformation.
[H3O+aq] fin =[ In-aq] fin = 10-6,3 =5,0 10-7 mol / L.
Taux d'avancement final : 5,0 10-7 / 0,10 = 5,0 10-6 << 1.
La transformation est partielle.
On considère que la seule réaction mise en jeu est celle de l’acide HIn avec l’eau.
C.3. Montrer qu’à l’équilibre l’expression de la constante d'acidité Ka du carmin d’indigo en
fonction du pH à l’équilibre de la solution et de sa concentration en quantité de matière en
soluté apporté c peut s’écrire :
Ka =
(10-pH)
2
/(c - 10-pH) × c°
avec c° = 1 mol·L–1
la concentration standard.
Ka = [H3O+aq] fin [In-aq] fin / ([InH]finc°).
[H3O+aq] fin =[In-aq] fin = 10-pH.
([InH]fin = c-[In-aq] fin =c - 10-pH.
C.4. Déterminer la valeur de la constante d’acidité Ka du couple HIn / In–
. En déduire la valeur
de son pKa.
Ka =
(10-pH)
2
(c - 10-pH) =10-12,6 / (0,10 -10-6,3) =10-11,6 =2,5 10-12 ; pKa = 11,6.
C.5. Tracer le diagramme de prédominance du carmin d’indigo en y faisant figurer les espèces
et leur couleur. Discuter de l’utilisation de cet indicateur coloré pour le titrage d’un acide
chlorhydrique par une solution d’hydroxyde de sodium.
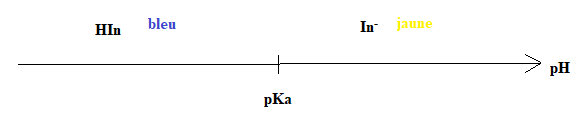
Zône de virage du carmin d'indigo ; 11 ; 13.
pH à l'équivalence lors du titrage d'un acide fort par une base forte pH = 7, hors de la zone de virage du carmin d'indigo.
Cet indicateur coloré ne convient pas.
|
...
|
....
|
D. Utilisation médicale du carmin d’indigo.
Le carmin d’indigo est utilisé dans le domaine médical pour colorer l’urine d’un patient en bleu
afin de réaliser certains diagnostics.
On dispose d’une solution injectable S de carmin d’indigo. L’objectif de cette partie est de
déterminer la concentration en masse de cette solution pour en déduire le volume maximal à
injecter pour ne pas dépasser la dose journalière admissible.
On donne ci-dessous le spectre d’absorption du carmin d’indigo.
On réalise un dosage spectrophotométrique par étalonnage de la solution S.
D.1. Déterminer la longueur d’onde adaptée à la réalisation de ce dosage dans le domaine
visible.
D.2. Justifier la couleur du carmin d’indigo.
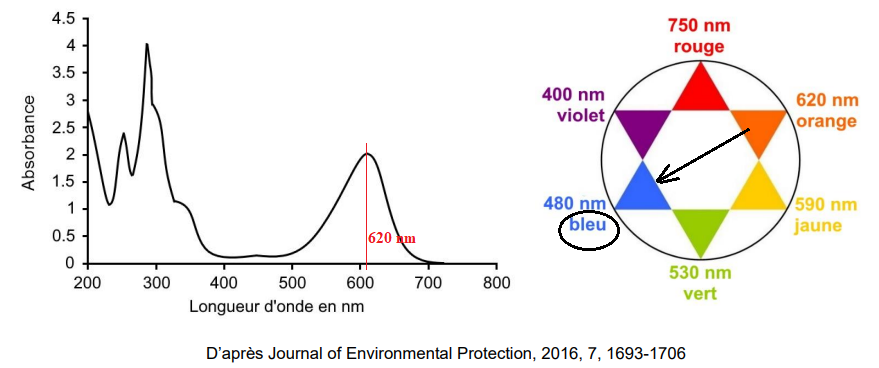
Le maximum d'absorption se situant vers 620 nm (orange), la solution
possède la couleur complémentaire de la couleur orange, soit le bleu.
On prépare un ensemble de solutions de carmin d’indigo à partir d'une solution mère Sm de
concentration connue cm = 80,0 mg·L-1 en carmin d’indigo.
Solution
|
S1
|
S2
|
S3
|
S4
|
S5
|
concentration (mg / L)
|
64,0
|
48,0
|
40,0
|
32,0
|
16,0
|
Absorbance
|
1,24
|
0,97
|
0,80
|
0,63
|
0,32
|
On dispose de la verrerie suivante :
- fioles jaugées de 25 mL, 50 mL, 100 mL ;
- pipettes jaugées de 5 mL, 10 mL, 20 mL, 25 mL ;
- béchers de 50 mL et de 100 mL ;
- éprouvettes graduées de 20 mL et 50 mL.
D.3. Décrire le protocole pour préparer 50 mL de la solution S3 à partir de la solution mère.
Facteur de dilution : F = 80,0 / 40,0 = 2.
Prélever 25,0 mL de solution mère à l'aide d'une pipette jaugée de 25,0 mL.
Verser dans la fiole jaugée de 50,0 mL contenant 1 /3 d'eau distillée.
Agiter et compléter avec de l'eau distillée jusqu'au trait de jauge.
Agiter pour rendre homogène.
La solution injectable S est diluée 200 fois pour obtenir la solution Sd dont on mesure
l’absorbance : A = 0,75.
La dose journalière admissible, notée DJA, de carmin d’indigo que l’on peut injecter à un patient
est 5,0 mg / jour / kg de masse corporelle.
D.4. Déterminer le volume de la solution S que l’on peut injecter sans danger en une journée
à un patient de 70 kg.
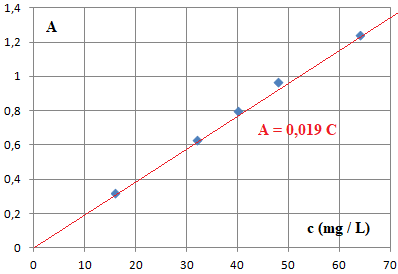
Solution Sd : =0,75 / 0,019 =39,5 mg / L.
Tenir compte de la dilution :39,5 x200 =7,9 103 mg / L oi 7,9 g / L.
Dose injectable 5,0 x70 = 350 mg = 0,35 g.
Volume de solution S que l'on peut injecter : 0,35 / 7,9 =4,4 10-2 L = 44 mL.
..
|
|