La
batterie au lithium-fer-phosphate, bac G
Amérique du Sud 2022.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
Données :
- charge élémentaire : e=1,60×10−19 C ;
- constante d’Avogadro : NA=6,02×1023 mol−1 ;
- équivalence ampère-heure / coulomb : 1,0 Ah=3,6×103 C ;
- masses molaires : M(LiC6)=78,9 g⋅mol−1 , M(FePO4)=150,8 g⋅mol−1.
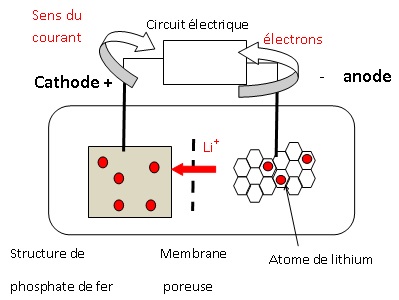
Caractéristiques de la batterie
L’électrode de phosphate de fer, FePO4, du compartiment 1 a
une masse m=4,7 kg et lorsque la batterie est chargée, l‘électrode du
compartiment 2 est recouverte d’une matrice de carbone lithié de
formule LiC6 pesant 1,1 kg. Les électrodes plongent dans un
électrolyte organique ionique contenant des ions lithium et les deux
compartiments sont séparés par une membrane.
Pour démarrer, la voiture nécessite une charge électrique qD=45 Ah.
Lors de la décharge de la batterie, les transformations chimiques en
jeu sont modélisables par deux réactions lectrochimiques aux électrodes
dont les équations figurent ci-dessous.
▪ Libération du lithium dans le compartiment 2 :
LiC6(s)=6 C(s) + Li++ e−.
▪ Formation de phosphate de fer lithié de formule LiFePO4 :
Li++e−+FePO4(s)=LiFePO4(s)
1. Identifier l’électrode où se produit une oxydation et celle où se produit une réduction. Justifier.
Compartiment 2 : LiC6(s) s'oxyde en libérant un électron, c'est l'anode négative.
Compartiment 1 : FePO4(s) gagne un électron, il joue le rôle d'oxydant qui se réduit ; c'est la cathode.
2. Reproduire
le schéma de la pile, indiquer les polarités des électrodes et
représenter les porteurs de charges et leur sens de circulation lorsque
la pile débite.
 3. Écrire l’équation de la réaction modélisant le fonctionnement de la pile.
3. Écrire l’équation de la réaction modélisant le fonctionnement de la pile.
Ajouter les demi-équations : LiC6(s) + Li++e−+FePO4(s)=6 C(s) + Li++ e−+LiFePO4(s)
Simplifier : LiC6(s) +FePO4(s)=6 C(s) +LiFePO4(s).
|
...
|
....
|
4.
La valeur de la constante d’équilibre de la réaction de fonctionnement
de la pile à 25 °C vaut K=1054. Conclure quant à la transformation
chimique mise en jeu dans la pile.
K étant très grande, la transformation chimique est totale.
5. Montrer que la valeur de l’avancement final de la transformation est xmax=14 mol. Indiquer ce qu’il se passe lorsque cette valeur est
atteinte lors du fonctionnement de la batterie ?
n(FePO4) = 4,7 103 / 150,8 =31,17 ~ 31 mol ( en excès).
n(LiC6(s))=1,1 103 / 78,9 =13,94 ~14 mol ( réactif limitant ).
L’avancement final de la transformation est xmax=14 mol.
Lorsque cette valeur est
atteinte lors du fonctionnement de la batterie, celle-ci est déchargée complètement.
6. Déterminer la valeur de la capacité électrique maximale Qmax de cette batterie.
Qmax = n(e-) F =n(e-) NA e=14 x6,02×1023 x1,60 10-19 =1,35 106 ~1,4 106 C.
Ou 1,35 106 / 3600 ~3,7 102 Ah.
7. Indiquer si la batterie permet le démarrage du véhicule.
Pour démarrer, la voiture nécessite une charge électrique qD=45 Ah.
La voiture peut démarrer qD < Qmax.
|
|