Solution
désinfectante , acide lactique, bac G Amérique du Sud 2022.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
Partie A. Étude de l’acide lactique
L’autre nom de l’acide lactique est l’acide 2-hydroxypropanoïque. Sa formule développée est la suivante :
1. Établir le schéma de Lewis de la molécule d’acide lactique. Entourer et nommer ses groupes caractéristiques.
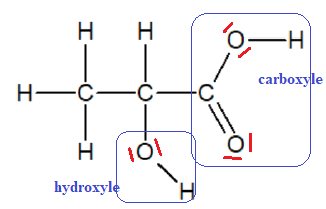
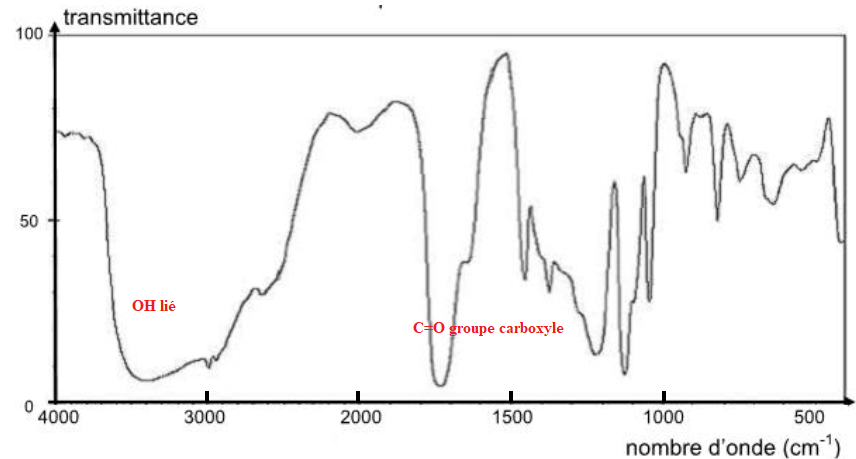
2. Le spectre IR de
l’acide lactique est reproduit ci-dessous. Identifier deux bandes
d’absorptions caractéristiques et repérer les liaisons correspondantes
sur le schéma de Lewis de la molécule d’acide lactique.
3. Vérifier
que la valeur de la concentration en acide lactique apporté dans la
solution désinfectante est voisine de 𝐶 = 0,20 mol⋅L−1.
100 g de solution désinfectante contient 1,75 g d’acide lactique ;
masse molaire de l’acide lactique : 𝑀 = 90,1 g⋅mol−1 ;
masse volumique de la solution désinfectante : r = 1,00 g⋅mL−1 ;
n = 1,75 / 90,1 =0,0194 mol dans 0,10 L soit C =0,0194 / 0,10 ~0,20 mol / L.
4. Rappeler la définition d’un acide de Brönsted.
Un acide de Brönsted est une espèce, ion ou molécule, susceptible de libérer un proton H+.
5. Expliquer pourquoi, dans ces conditions, l’acide lactique est un acide faible. Un argument quantitatif est attendu.
pH de la solution désinfectante : pH = 2,3.
-log C = -log 0,20 ½=0,70.
Le pH mesuré est bien supérieur à 0,70 ; l'acide lactique est un acide faible.
On note AH la molécule d’acide lactique pour la suite de l’exercice.
6. Écrire l’équation de la réaction modélisant la mise en solution aqueuse de cet acide.
AH aq + H2O(l) =A-aq + H3O+aq.
7. Compléte le tableau d’avancement associé à cette transformation chimique à l’aide des notations de l’énoncé : C, pH, V et C0, avec C0 = 1 mol⋅L−1, concentration standard.
|
Avancement (mol
|
AH aq |
+ H2O(l) |
= A-aq |
+ H3O+aq. |
initial
|
0
|
CV
|
solvant
|
0
|
0
|
final
|
xf = 10-pH V |
CV-10-pH V |
10-pH V |
10-pH V
|
8. En utilisant la question précédente, exprimer la constante d’acidité Ka du couple AH/A−
en fonction des différentes concentrations à l’équilibre. En déduire la
valeur de cette constante d’acidité. Commenter, sachant que la valeur
de référence du pKa du couple acide lactique/ion lactate vaut 3,9.
Ka = [A-aq] [H3O+aq] / ([
AH aq]C0 ) =(10-pH )2 / ((C-10-pH )C0)=10-4,6 / (0,2 -10-2,3) =1,3 10-4.
pKa = - log(Ka) = 3,9, en accord avec la valeur de référence.
9. Un programme Python permet de tracer le diagramme de distribution du couple acide lactique/ion lactate noté AH/A−.
9.1. Établir, d’une part, la relation entre la concentration 𝐶 en acide lactique apporté, [AH]éq et [A- ]éq, et d’autre part la relation pH = pKa + log ([A- ]éq / [AH]éq).
Ka = [A-aq] [H3O+aq] / ([
AH aq]C0 )
log(Ka) = log [H3O+aq] éq+log ([A- ]éq / [AH]éq )
-log(Ka) = -log [H3O+aq] éq-log ([A- ]éq / [AH]éq )
pKa = pH -log ([A- ]éq / [AH]éq )
pH = pKa + log ([A- ]éq / [AH]éq).
C =[AH]éq + [A- ]éq,
9.2. À partir de ces deux relations, montrer que le pourcentage en acide AH, défini par 100[AH]éq / C , peut s’écrire100 / (1+10pH-pKa).
pH - pKa = log ([A- ]éq / [AH]éq).
10pH-pKa=[A- ]éq / [AH]éq ;
[A- ]éq = C-[AH]éq .
10pH-pKa=(C-[AH]éq ) / [AH]éq =C / [AH]éq -1 ; 1+10pH-pKa=C / [AH]éq ; [AH]éq =C /(1+10pH-pKa).
100[AH]éq / C =100 /(1+10pH-pKa).
9.3. Un programme Python permet de tracer le diagramme de distribution du couple acide lactique/ion lactate noté AH/A−.
Indiquer à quelle espèce chimique correspond la courbe 1. Justifier.
Expliquer comment il est possible de retrouver la valeur du pKa à
partir d’une lecture graphique.
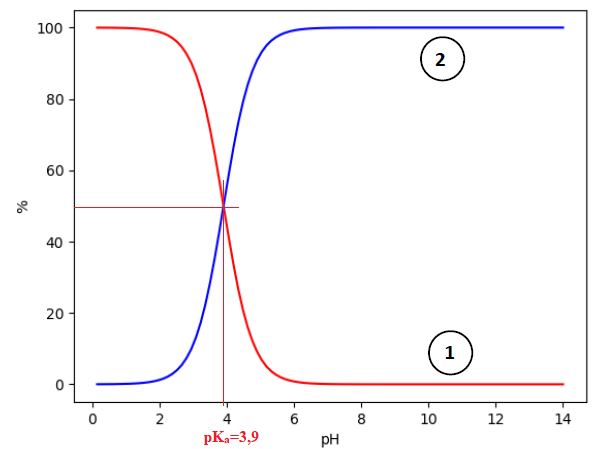
A pH inférieur à pKa, l'acide lactique est majoritairement sous la
forme AH et à pH supérieur à pKa, cet acide est majoritairement sous la
forme A-. La courbe 1 correspond donc à AH.
A pH = pKa : [A- ]éq =[AH]éq ; à partir de 50 % tracer une horizontale puis une verticale à partir de l'intersection des deux courbes.
|
...
|
....
|
Partie B. Titrage de l’acide lactique dans la solution désinfectante
Avant la commercialisation du produit, un laboratoire réalise un test
de qualité sur sa solution désinfectante. Pour cela, un titrage
acido-basique suivi par conductimétrie est réalisé après avoir dilué la
solution désinfectante.
1. Proposer un protocole expérimental pour préparer 100,0 mL de solution désinfectante diluée 5 fois.
Prélever 10 mL de solution commerciale à l'aide d'une pipette jaugée.
Verser dans une fiole jaugée de 50 mL contenant un tiers d'eau distillée. Agiter.
Compléter jusqu'au trait de jauge à l'aide d'eau distillée. Boucher et agiter pour rendre homogène.
Dans un bécher de 250 mL, on introduit un volume 𝑉𝐴 = 20,0
± 0,05 mL de la solution désinfectante diluée. On ajoute 150 mL d’eau
distillée. Le titrage est réalisé par une solution aqueuse d’hydroxyde
de sodium de concentration en soluté apporté CB = (1,0 ± 0,1) × 10−1 mol⋅L−1.
. La courbe obtenue est donnée.
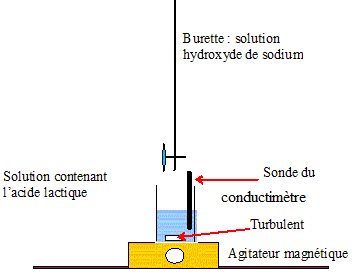
2. Schématiser et légender le dispositif de titrage.
3. Écrire l’équation de la réaction support du titrage.
AH aq + HO-aq --> A-aq + H2O(l).
4. Interpréter qualitativement le changement de pente au voisinage de l’équivalence observé sur la courbe de titrage.
Avant l'équivalence HO- en défaut : on ajoute des ion sodium, la conductivité de la solution croît lentement ;
après l'équivalence, HO- en excès, on
ajoute des ion sodium et des ions hydroxyde de conductivité molaire
ionique élevée, la conductivité de la solution croît fortement.
5. Déterminer graphiquement la valeur du volume à l’équivalence 𝑉𝐸 .
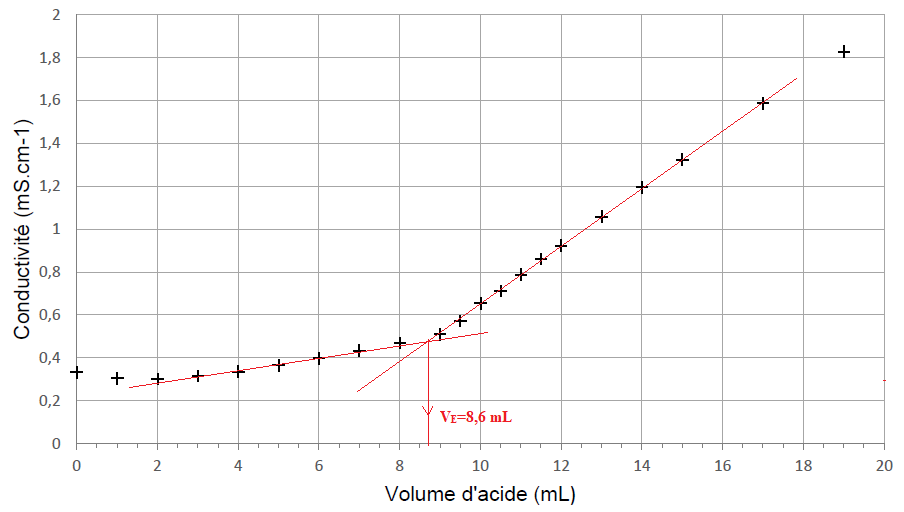
On considère par la suite que l’incertitude-type sur 𝑉𝐸 est 𝑢(𝑉𝐸 ) = 0,1 mL.
6. Évaluer la
concentration 𝐶 de la solution en acide lactique avant dilution.
Évaluer l’incertitude type sur la mesure sans prendre en compte la
contribution liée à la dilution. Commenter.
C = CB VE / VA =0,10 x 8,6 / 20 =0,043 mol / L.
u(C) =C [(u(CB) / CB)2+(u(VE) / VE)2+(u(VA) / VA)2]½ = 0,043 [(0,1)2+(0,1 / 8,6)2+(0,05 / 20)2]½ =0,043 (0,01 +1,35 10-4 +6,25 10-6)½ ~4,3 10-3 mol / L.
C = 0,043 ±0,005 mol /L.
Tenir compte de la dilution :( 0,043 ± 0,0043) x5 = 0,21 ±0,02 mol / L.
0,20 mol/ L appartient à [0,19 ; 0,23]. Donc accord avec l'indication du fabricant.
|
|