Mathématiques,
cinétique, acide base, l'adrénaline, bac STL Métropole 2022.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
Mathématiques.
1
Soit la fonction 𝑓 définie et dérivable sur R par f(x) = (8x − 2)e-x.
On note f ' sa fonction dérivée.
Déterminer f '(x)
(𝑥) pour tout 𝑥 réel.
On pose u = 8x-2 et v = e-x
; u' = 8, v' = -e-x.
u'v +v'u = 8e-x-(8x-2)e-x=(10-8x)e-x.
2. Soit la fonction
𝑓 définie sur ℝ par
𝑓(𝑥) = (8𝑥 − 2)𝑒
−𝑥
Résoudre 𝑓(𝑥) = 0.
e-x >0.
8x-2 = 0 ; 8x = 2 ; 4x = 1 soit x = 0,25.
3. On considère une
fonction 𝑔 définie et dérivable sur l’intervalle [0 ; 13].
On note g
′ sa fonction dérivée.
On donne ci-dessous la courbe représentative de la fonction dérivée g
′ sur l’intervalle
[0 ; 13].
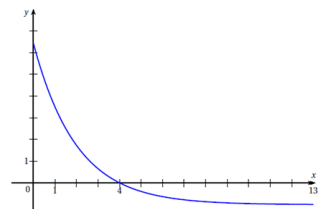
Julien affirme que la fonction 𝑔 est décroissante sur l’intervalle [0
;13].
Julien a-t-il raison ? Justifier.
g '(x) > sur [0 ; 4] et g(x) est croissante.
g '(x)
< sur [4 ; 13] et g(x) est décroissante.
Julien a tord.
4. Montrer que ln(√8)
/ ln(√2)
= 3.
ln(8½)=0,5
ln(8) =0,5 ln(23) = 0,5 x3 ln(2) = 1,5 ln(2).
ln(2½) = 0,5 ln(2).
Par suite : 1,5 ln(2) / (0,5 ln(2) = 1,5 /0,5 = 3.
5. Soit 𝑓 la fonction définie et dérivable
sur R par f(x) = e
6𝑥 − 1.
Déterminer la limite de la fonction 𝑓 lorsque 𝑥 tend vers moins
l'infini.
Le terme en exponentielle tend vers zéro et f(x) tend vers -1.
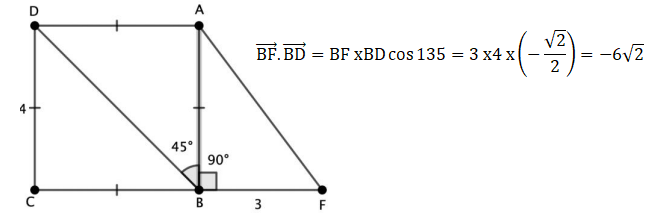
6. ABCD est un
carré de côté 4 et ABF est un triangle rectangle en B avec BF= 3 comme
indiqué sur la figure ci-dessous.
Donner la valeur du produit scalaire suivant :
Cinétique chimique,
réactions acido-basiques.
Apportée au sol, l’urée, de formule CO(NH2)2
doit être transformée en ions ammonium
(NH4
+
) puis en ions nitrate (NO3
-
) avant que les plantes ne puissent l’absorber.
Les enzymes uréases du sol sont des vecteurs de ce processus qui
comporte une étape
d’hydrolyse.
Source : d’après
https://www.yara.fr/fertilisation/pur-nutriment/urease-inhibitors.
La réaction d’hydrolyse de l’urée libère des ions ammonium NH4
+
et carbonate CO3
2-
selon
l’équation suivante :
CO(NH2)
2
(aq) + 2 H2O (ℓ) → 2 NH4
+
(aq) + CO3
2-
(aq)
L’objectif de cet exercice est d’étudier la cinétique de cette
réaction d’hydrolyse de l’urée.
On réalise pour cela trois expériences de suivi cinétique de celle-ci,
où l’eau est toujours
en large excès.
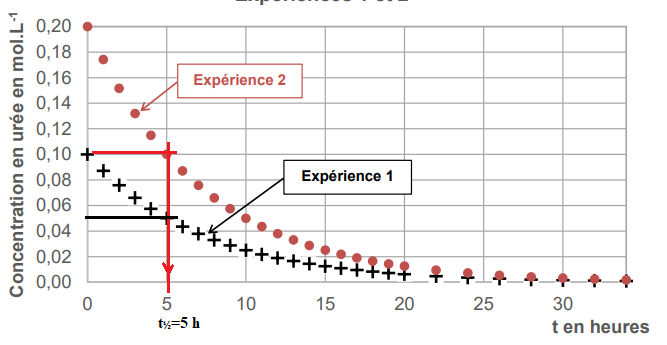
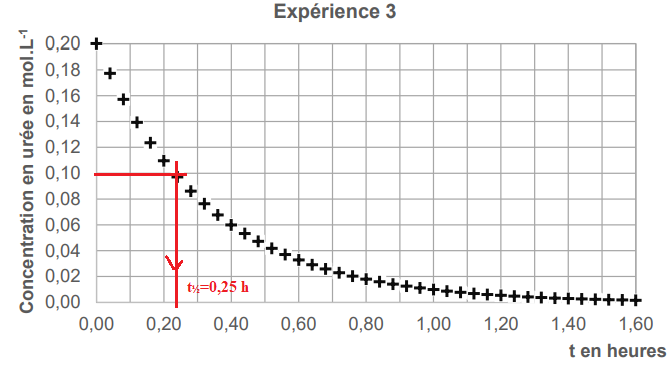
Expérience
1 : concentration initiale en urée : 0,10 mol / L ; température : 75°C.
Expérience 2 : concentration initiale en urée :
0,20 mol / L ; température : 75°C.
Expérience 3 : concentration initiale en urée :
0,20 mol / L ; température : 95°C.
Les courbes tracées grâce à ces
expériences sont présentées.
1. Définir le temps de demi-réaction.
Le temps de demi-raction est le temps au bout duquel l'avancement est
égal à la moitié de l'avancement final.
2. Déterminer
graphiquement la valeur du temps de demi-réaction pour chacune des
trois
expériences. Les traits de construction apparaîtront sur chaque courbe.
3. En déduire l’influence
de la concentration initiale en urée sur la durée de la
transformation chimique. Justifier.
La concentration de l'urée n'influence pas la transformation. (égalité
des temps de demi-réaction expériences 1 et 2).
4. À l’aide
des résultats de la question 2, déterminer l’influence de la
température sur la
durée de la transformation chimique. Justifier.
La température est un facteur cinétique.
(comparaison des temps de demi-réaction expériences 3 et 2).
5. Expliquer pourquoi la température
peut être qualifiée de « facteur cinétique ».
Une augmentation de température accroît la vitesse de laréaction.
On s’intéresse désormais uniquement à l’expérience 1.
6. Écrire la
relation de définition de la vitesse de disparition de l’urée au cours
du temps.
v = - d[urée] / dt.
La courbe ci-dessous présente l’évolution de la vitesse de
disparition de l'urée en fonction
de la concentration en urée.
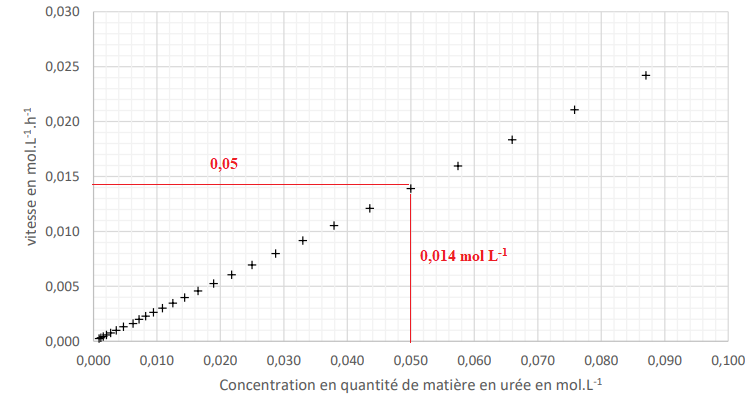
7. À l’aide de la
courbe ci-dessus, montrer que la réaction d’hydrolyse de l’urée suit
une
loi de vitesse d’ordre 1 par rapport à l’urée.
La vitesse est proportionnelle à la concentration de l'urée v = k
[urée] avec k une constante.
8. À partir de la
relation écrite à la question 6, établir la loi d’évolution de la
concentration
en urée au cours du temps en fonction de la constante de vitesse k et
de la
concentration initiale en urée notée [urée]0.
- d[urée] / dt. = k
[urée]
d[urée] / [urée] = -kdt.
Intégrer entre 0 et t : ln [urée]-ln[urée]0 = -kt.
[urée] = urée]0
e-kt.
9. Déterminer graphiquement la
constante de vitesse k en h-1
Coefficient directeur de
la droite : 0,014 / 0,05 =0,28 h-1.
10. On reproduit
l’expérience 1 en présence d’une enzyme naturellement présente dans
les sols : l’uréase. On détermine alors un temps de demi-réaction égal
à 2 µs. Indiquer
le rôle joué par l’uréase. Expliquer la réponse.
L'uréase joue le rôle de catalyseur enzymatique qui augmente la vitesse
de la réaction..
La dissolution de granulés d’urée dans le sol entraîne localement
une augmentation
temporaire du pH du sol liée à la formation d’ions hydroxyde HO-
. L’ion ammonium, lié
aux particules du sol, se transforme alors en ammoniac gazeux (NH3)
qui s’échappe dans
l’atmosphère, augmentant les pertes en élément azote par
volatilisation.
11. La
transformation des ions ammonium NH4
+
en ammoniac gazeux NH3 fait intervenir
les couples acide-base NH4
+
/ NH3 et H2O / HO-
. Écrire les équations de réactions
acido-basiques associées à chacun de ces deux couples acide-base.
NH4
+
aq --> NH3aq +H+aq
HO-aq + H+aq --> H2O(l).
12. En déduire l’équation de la
réaction modélisant la transformation chimique entre les
ions ammonium NH4
+
et les ions hydroxyde HO-
.
NH4
+
aq +HO-aq--> NH3aq + H2O(l).
13. Justifier que
cette réaction est bien une réaction acido-basique.
Il y a échange de proton entre l'acide NH4
+ et la base HO-.
|
...
|
....
|
L'adrénaline
Étude
de la structure de l'adrénaline.
1. Entourer le groupe
caractéristique correspondant à la fonction amine.
2. Repérer
par un
astérisque le (ou les) carbone(s) asymétrique(s). Indiquer si cette
molécule est chirale.
Justifier.
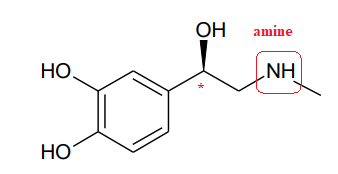
La molécule possède un atome de carbone asymétrique, donc elle est chirale.
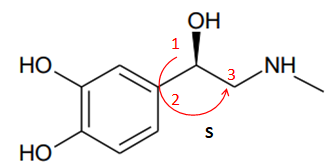
3. Classer les groupes liés au(x) carbone(s) asymétrique(s) à l’aide
des règles de Cahn,
Ingold et Prelog en expliquant la démarche suivie.
4. En déduire la configuration absolue (R ou S) de la forme naturelle
de la molécule
d’adrénaline en expliquant la démarche suivie.
5. Représenter en perspective de Cram un stéréoisomère de la molécule
d’adrénaline
différent de celui de sa forme naturelle fournie. Préciser la relation
d’isomérie qui existe entre ces deux molécules.
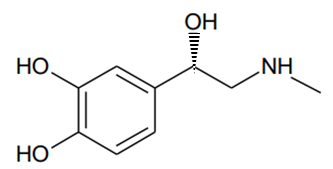
Ce sont deux énantiomères.
Étude de la structure et de propriétés acido-basiques de l’éphédrine.
La molécule d’éphédrine a une structure voisine de l’adrénaline dont elle renforce l’action.
La configuration absolue de la molécule E1 est (1R, 2S).
Un stéréoisomère de la molécule E1 est représenté ci-dessous. Il sera noté molécule E2.
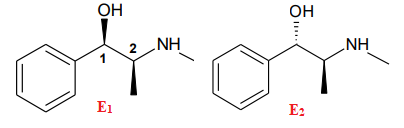
6. Indiquer la configuration absolue de la molécule E2.
(1S, 2S)
7. Nommer la relation de stéréoisomérie existant entre la molécule E1 et la molécule E2.
Justifier.
Un seul atome de carbone change de configuration, donc diastéréoisomères.
On note à présent B la molécule d’éphédrine et BH+ son acide conjugué.
Le pKa du couple BH+
/ B mettant en jeu l’éphédrine est égal à 9,65.
La valeur du pH du sang est comprise entre 7,32 et 7,42.
- Couples acide-base de l’eau : H3O+
/ H2O et H2O / HO-
.
8. Définir une base au sens de Brönsted.
Une base de Brönsted est une espèce susceptible de gagner un proton H+.
9. Écrire l’équation de réaction de l’éphédrine avec l’eau.
Baq +H2O(l) --> BH+aq +HO-aq.
10. Représenter le diagramme de prédominance du couple BH+
/ B.
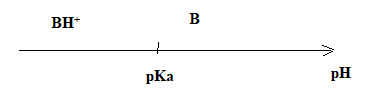
11. Indiquer l’espèce prédominante du couple BH+
/ B dans le sang. Justifier la réponse.
A pH < pKa, la forme BH+ prédomine.
|
|