Le sang humain est un liquide biologique dont le pH doit être maintenu dans un intervalle
de valeurs très étroit car la survie des cellules de l’organisme en dépend. Pour une personne
en bonne santé, le pH sanguin peut varier entre 7,36 et 7,44 ; cette régulation est assurée
par des systèmes tampon. L’un d’entre eux fait intervenir le couple acide base acide
carbonique/ion hydrogénocarbonate H
2O,CO
2(aq) / HCO
3
− (aq). Lors d’un effort physique
intense, de l’acide lactique de formule brute C
3H
6O
3 peut se former dans les muscles et être
transféré dans le sang. Le pH sanguin diminue mais le système de régulation permet de
rétablir le pH du sang à une valeur proche de sa valeur initiale.
La relation à l’équilibre entre le pH de la solution et le pKa du couple
H2O,CO2(aq) / HCO3
− (aq) est :
pH = pKa + log([
HCO3
− (aq) ] / [
H2O,CO2(aq] ).
Le pKa du couple acide base
H2O,CO2(aq) / HCO3
− (aq) vaut 6,1 à la température de
37 °C
1. Recopier et compléter la demi-équation acide-base associée au couple
H2O,CO2(aq) / HCO3
− (aq) :
H
2O, CO
2
(aq) + H
20(l) ⇌
HCO3
− (aq) +
H3O+aq.
2. Représenter le diagramme de prédominance du couple
H2O,CO2(aq) / HCO3
− (aq) . En
déduire quelle est l’espèce prédominante dans le sang d’un patient en bonne santé.
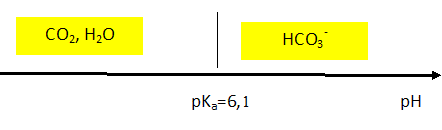
A pH > pK
a,
HCO3
− (aq) prédomine.
3. Citer les propriétés d’une solution tampon. Expliquer, dans le cas du sang humain, le
rôle des systèmes tampon.
Une solution tampon modère les variations de pH suite à l'ajout modéré d'un acide ou d'une base, lors d'une dilution.
Dans le cas du sang humain, le
rôle des systèmes tampon est de maintenir le pH du sang entre 7,36 et 7,44.
En cas de perturbation des mécanismes régulateurs, une variation trop importante du pH
sanguin peut induire de graves conséquences sur l’état de santé d’une personne. Afin
d’établir le diagnostic d’une acidose (diminution du pH) ou d’une alcalose (augmentation du
pH) et proposer un traitement adapté, les médecins utilisent le diagramme de Davenport
présenté ci-après. Deux patients ont réalisé des examens ; le point N correspond à un
patient hospitalisé pour lequel les examens sont normaux et le point A correspond aux
résultats obtenus pour un second patient hospitalisé.
4. Déterminer la valeur du pH du sang et la concentration en ions hydrogénocarbonate
dans le sang du patient pour lequel les examens sont normaux.
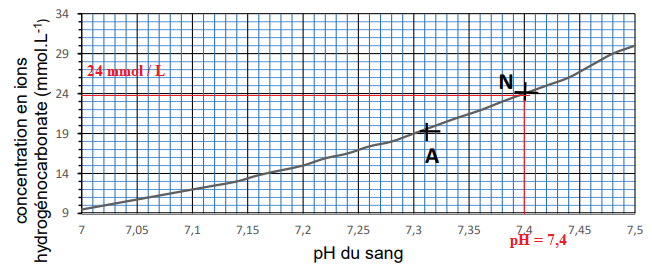 5.
5. Déterminer la concentration en acide carbonique
H
2O, CO
2(aq) dans le sang du patient pour lequel les examens sont normaux.
pH = pKa + log([HCO3
− (aq) ] / [H2O,CO2(aq] ).
7,4 = 6,1 + log([24 / [H2O,CO2(aq] ).
1,3 = log (24) - log [H2O,CO2(aq].
log [H2O,CO2(aq]=1,38-1,3 = 0,08 ; [H2O,CO2(aq]=1,2 mmol / L.
6. Préciser, en expliquant la réponse, si le médecin diagnostiquera une acidose ou une
alcalose dans le cas du patient pour lequel les résultats correspondent au point A.
Préciser si un traitement s’avère nécessaire pour revenir à un état normal.
pH correspondant au point A : 7,31. Diminution du pH, donc acidose.
Un traitement s’avère nécessaire pour revenir à un état normal.
7. Expliquer si une hyperventilation (succession rapide de
grandes inspirations et expirations) peut être recommandée comme traitement de ce
patient pour un retour à l’état normal.
Une hyperventilation va éliminer une partie du CO
2 dissout dans le sang.
[H2O,CO2(aq] diminue ; [HCO3
− (aq) ] / [H2O,CO2(aq] va augmenter.
log([HCO3
− (aq) ] / [H2O,CO2(aq] ) croît.
Le pH du sang va augmenter.
Une hyperventilation peut être recommandée.