Robot
d'assistance à la personne Roméo, le dégivrage, bac STI2D Mayotte
2022.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
Exercice 2.
L’énergie utilisée par Romeo est stockée à l’emplacement du cœur et des
poumons
d’un humain. Elle provient d’un assemblage d’accumulateurs connectés en
série et en
parallèle. Cet assemblage sera désigné sous le nom de « pack
batterie ».
Le pack batterie doit avoir une tension nominale de 48 V et une
capacité nominale de
3300 mAh. Les accumulateurs BM18650ETC1 qui le composent sont décrits
cidessous.
Masse : 38,8 g
; Tension nominale : 3,2 V
; Capacité nominale : 1100 mAh
1. Déterminer le
nombre d’accumulateurs à placer en série et en parallèle pour
obtenir le pack batterie complet qui alimente le robot Romeo. Justifier
votre
réponse.
48 / 3,2 = 15 accumulateurs en série.
3300 / 1100 = 3 séries de 15 accumulateurs en parallèle.
Pour la suite de l’exercice, on admet que le pack batterie est
constitué de 45
accumulateurs au Lithium Fer Phosphate LiFePO4.
2. Déterminer la masse du pack
batterie.
38,8 x 45=1746 g ~1,75 kg.
3. Déterminer l’énergie
que peut fournir le pack batterie.
Tension nominale x capacité nominale = 48 x 3,3 ~158 Wh.
4. Justifier le
choix de la technologie LiFePO4 pour assurer l’autonomie
énergétique
du robot Romeo.
L'énergie massique de cette batterie est supérieure à celles des
batteries au plomb ou au nickel cadmium.
5. En considérant que la
valeur moyenne de l’intensité du courant débité est de
2,8 A, déterminer l’autonomie de fonctionnement du robot. Exprimer le
résultat
en minute. Commenter.
3,3 / 2,8 =1,18 h ou 1 h 11 min.
Cette autonomie est faible.
Lors de la décharge d’un accumulateur LiFePO4, les équations
modélisant les
transformations électrochimiques qui se produisent aux électrodes sont
les suivantes :
à la borne + : FePO4 (s) + Li+ + e
- --> LiFePO4 (s)
à la borne - : LiC6 (s) --> 6 C (s) + Li+ + e-.
6. Écrire
l’équation de la réaction modélisant la décharge de l’accumulateur.
Ajouter : FePO4 (s) + Li+
+ e
- +LiC6 (s) -->
LiFePO4 (s)
+6 C (s) + Li+ + e-.
Simplifier :
FePO4 (s) + LiC6 (s) -->
LiFePO4 (s)
+6 C (s) .
7. Lors de la décharge de
l’accumulateur, préciser si l’on observe, à la borne
négative, une réaction d’oxydation ou de réduction. Justifier votre
réponse.
LiC6 (s) cède des électrons ;
c'est un réducteur qui s'oxyde. Donc oxydation.
8. On rappelle que la capacité
nominale d’un accumulateur est de 1100 mAh.
Déterminer la quantité de matière d’électrons que doit faire
circuler
l’accumulateur lors de sa décharge complète.
1,1 Ah ou 1,1 x 3600 =3960 C.
ne- = 3960 / 96500 =4,1 10-2 mol.
9. En déduire la masse
nécessaire de chacune des électrodes FePO4 et LiC6
présentes dans un accumulateur.
n(FePO4) = ne- = 4,1 10-2
mol ; M= 55,8 +31 +4 x16=150,8 g / mol ; masse : 150,8 x4,1 10-2 =6,18 g.
n(LiC6) = ne- = 4,1 10-2
mol ; M= 6,9 +6 x12=78,9 g / mol ; masse : 150,8 x4,1 10-2 =3,23 g.
Afin de déterminer
la tension à vide du pack batterie, on a mesuré 10 fois cette grandeur
à l’aide d’un voltmètre. Les mesures obtenues sont les suivantes.
48,6 ; 48,4 ; 49,6 ; 49,0 ; 47,8 ; 50,0 ; 48,4 ; 49,7 ; 49,0 ; 48,6.
10.
Déterminer la valeur moyenne U0m des 10 mesures de la tension à vide.
11. Déterminer l’écart-type expérimental.
Moyenne : 48,9 V.
Ecart type : s =
0,687.
12. En déduire la
valeur de l’incertitude-type par une approche statistique (type A)
sur la moyenne u(𝑈0𝑚 ) de la tension à vide
u(𝑈0𝑚 ) = s / n½ = 0,687 / 10½ =0,22 V.
U0m = 48,9 ±0,3 V.
.
Un technicien de l'entreprise Aldebaran Robotics décide de contrôler le
pack batterie
pour l’un des robots. Il utilise le même multimètre que précédemment et
effectue une
moyenne sur 10 mesures. Il détermine une valeur moyenne U0m
= 48,9 V. La tension de
référence est 48,0 V.
13. Comparer la
valeur moyenne mesurée et la valeur de référence en nombre
d’incertitudes-types les séparant. Conclure quant à la conformité de ce
pack
batterie.
|Uréf - U0m| / u(Um0)=(48,9-48) /
0,22 ~4.
Cette valeur étant supérieure à 3, le pack n'est pas conforme.
|
...
|
....
|
Le dégivrage.
On s'intéresse ici au
dégivrage d'un avion par apport d'énergie thermique.
Données :
Capacité thermique massique de l'eau liquide : 𝑐𝑒𝑙 = 4180 J∙kg-1
∙K-1
Capacité thermique massique de l'eau solide : 𝑐𝑒𝑠 = 2090 J∙kg-1
∙K-1
Chaleur latente de fusion de la glace à 0°C :L = 333 kJ∙kg-1
Masse volumique de l’eau liquide à 25°C : rel = 1,0
kg∙L
-1
Masse volumique de l’eau solide à -10°C : res = 0,92 kg∙L
-1
Une surface de 5,0 m2 de glace recouvre l’aile d’un avion sur une
épaisseur d'un demi-millimètre. La température de la glace est q1 = -
10°C.
1. Déterminer la masse de glace 𝑚 déposée sur l’aile de l’avion.
Volume de glace : 5,0 x 5 10-4 =2,5 10-3 m3 =2,5 dm3 = 2,5 L.
Masse = 2,5 x 0,92 =2,3 kg.
2. Exprimer puis déterminer la valeur 𝐸1 de l'énergie nécessaire pour
augmenter la
température de la glace de -10°C à 0°C.
E1 = m𝑐𝑒𝑠 Dq =2,5 x2090 x10 =5,2 104 J = 52 kJ..
3. Exprimer puis déterminer la valeur 𝐸2 de l'énergie nécessaire pour
transformer à
0°C la glace en eau liquide.
E1 = mL = 2,3 x333 =7,7 102 kJ.
4. En déduire la valeur de l'énergie totale nécessaire à cette
opération de dégivrage.
7,7 102 +52 =8,2 102 kJ.
Cette énergie est apportée par une batterie délivrant une tension
commune continue
𝑈 = 28,0 V et alimentant cinq éléments chauffants résistifs
(symbolisés par un
conducteur ohmique de résistance globale 𝑅), répartis sur l’ensemble
de l’aile et
consommant chacun une puissance électrique 𝑃𝐸 = 250 W.
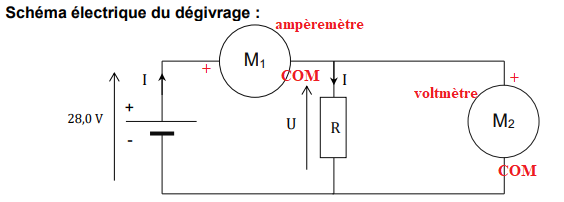
5. Nommer et identifier les appareils M1 et M2 permettant la mesure de la tension
aux bornes du conducteur ohmique de résistance 𝑅 et de l’intensité du courant
dans le circuit.
6. Préciser les polarités de chaque appareil de mesure.
7. Déterminer la valeur de l’incertitude-type de la tension sachant que le multimètre
affiche une valeur de tension de 28,02 V.
Incertitude type : ±0,5 % de la valeur lue = ± 28,02 x 0,5 / 100= ±0,14 V.
8. Ecrire le résultat de la mesure de la tension avec l’incertitude-type associée.
U =28,02 ±0,14 V
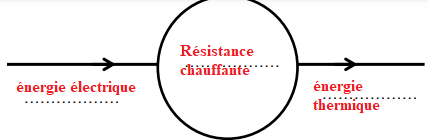
9. Recopier sur votre copie et compléter la chaîne énergétique de la résistance
chauffante.
10. Déterminer la valeur de la puissance de la batterie nécessaire afin d’alimenter la
totalité des résistances.
5 PE = 5 x 250 = 1250 W.
11. En admettant qu’il n’y a pas de perte thermique au niveau des éléments
chauffants résistifs, déterminer la durée permettant le dégivrage complet de
l’aile. Commenter le résultat.
t = énergie (J) / puissance (W)=8,2 105 / 1250 =656 s ou 10 min 56 s. C'est assez rapide.
|
|