Produit
détachant et lessive, dormir en refuge, bac STI2D Métropole
2022.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
1.
Composition de la lessive.
Les lessives liquides sont composées de fortes quantités de
carbonates ; en
moyenne 30 % de la masse d’une lessive est constituée de carbonate de
calcium
CaCO3(s).
La dissolution du CaCO3(s) libère des ions calcium Ca2+(aq)
et des ions carbonate
CO3
2-
(aq) selon l’équation-bilan :
CaCO3(s) = Ca2+(aq)+ CO3
2-
(aq).
L’ion carbonate CO3
2-
(aq), appartient au
couple acido-basique HCO3
-
(aq)/CO3
2-
(aq).
L’eau intervient alors dans le couple acido-basique H2O(l)/HO-
(aq).
1.1. Lors d’un cycle de
lavage, une masse de 50 g de lessive est introduite dans le
tambour où se trouve un volume d’eau égal à 20 L.
Calculer la concentration molaire en ions carbonate résultant de la
dissolution
totale de la lessive dans l’eau contenue dans le tambour de la machine
à
laver.
Masse de carbonate de calcium : 50 x0,30 = 15 g.
M(CaCO3) = 40 +12 +3 x16 =100g / mol.
n =15 /100 = 0,15 mol.
Concentration : 0,15 / 20 =7,5 10-3 mol / L.
1.2. Écrire
l’équation-bilan de la réaction de l’ion carbonate CO3
2-
(aq) sur l’eau H2O(l)
En déduire l’influence de la présence d’ions carbonate sur le pH de
l’eau de
lavage.
CO3
2-
(aq) + H2O(l) --> HCO3
-
(aq) +HO-aq.
Des ions hydroxydes sont libérés et le pH augmente.
2. Agents de blanchiment.
Dans les lessives dites à « l’oxygène actif » le peroxyde
d’hydrogène H2O2 (ou eau
oxygénée) est l’agent de blanchiment. Comme le peroxyde
d'hydrogène est
difficile à conserver longtemps en solution aqueuse, les lessives
contiennent des
produits capables de libérer de l’eau oxygénée au contact de l’eau.
C’est le cas du
perborate de sodium tétrahydraté NaBO3,4H2O. Ce
composé est stable à
température ambiante mais réagit avec l’eau à 60°C, la réaction
libérant du peroxyde
d'hydrogène.
Données :
Couples d’oxydoréduction mis en jeu : NaBO3(aq) / NaBO2(aq)
et H2O2(aq) / H2O(l).
2.1. Écrire l’équation de
la réaction qui modélise l’action du perborate de sodium
sur l’eau, conduisant à la formation du peroxyde d’hydrogène.
NaBO3(aq) + H2O(l) -->NaBO2(aq)+
H2O2(aq).
En solution
aqueuse, le peroxyde d’hydrogène peut réagir avec lui-même (on parle
de réaction de dismutation), ce qui explique que l’on ne peut le
conserver longtemps
sous cette forme. Cette réaction met en évidence les propriétés
oxydantes et
réductrices du peroxyde d’hydrogène.
Les deux demi-équations électroniques correspondantes sont :
H2O2(aq) + 2H+
(aq) + 2e– = 2H2O(l) (1)
H2O2(aq) = O2(g) + 2H+
(aq) + 2e–
(2).
2.2. Préciser si, dans la
demi-équation (1), le peroxyde d'hydrogène est
l’oxydant ou le réducteur. Justifier.
H2O2 gagne des électrons, c'est un oxydant qui se
réduit.
2.3. Préciser le couple
oxydant/réducteur mis en jeu dans la demi-équation (2).
O2(g) / H2O2(aq)
2.4. Écrire l’équation de la
réaction qui modélise l’action du peroxyde d’hydrogène
sur lui-même à partir des demi-équations (1) et (2). Identifier les
produits de la
réaction.
2H2O2aq = O2 (g) + 2H2O(l).
( dioxygène et eau ).
3. Azurants optiques.
Certaines fibres naturelles absorbent la lumière bleue, ce qui
donne un aspect
jaunâtre au linge. Pour éviter cet effet, les lessives contiennent des
azurants
optiques. Ces molécules absorbent les rayonnements électromagnétiques
ultraviolets et réémettent ensuite cette énergie sous forme de
rayonnement visible
(c’est le phénomène de fluorescence). Un azurant optique émet des ondes
électromagnétiques avec un maximum dans les longueurs d’onde
correspondant à la
couleur bleue.
L’azurant optique donne ainsi un « éclat de blancheur » au tissu lavé.
3.1. Préciser les longueurs d’ondes
qui délimitent le domaine électromagnétique
visible. Indiquer où se situe le domaine des longueurs d’ondes des
rayonnements ultraviolets par rapport à celui du domaine visible.
Visible : 400 nm - 800 nm.
UV : longueurs d'onde inférieures à 400 nm.
3.2. Déterminer, à
l’aide des spectres suivants, la valeur de la longueur d’onde
correspondant au maximum d’émission de l’azurant optique.
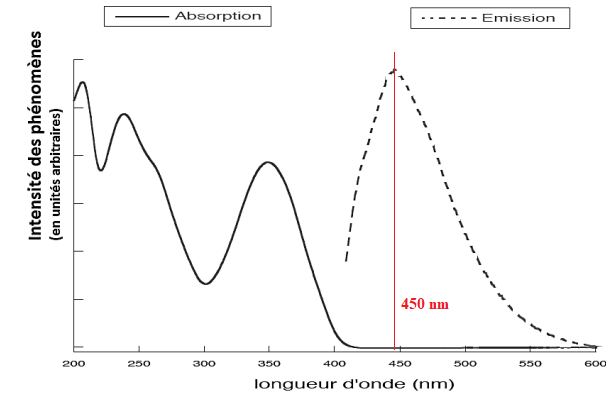
Les agents azurants sont peu ou pas toxiques. Ils sont difficilement
biodégradables
et leur potentiel de bioaccumulation est considéré comme étant
négligeable. En
raison de leur utilisation majeure dans les détergents, leur principal
impact
écotoxicologique devrait se situer au niveau des espèces aquatiques.
D’après l’article https://fr.wikipedia.org/wiki/Agent_azurant
3.3. Identifier le
pictogramme de danger des azurants optiques en indiquant son
code.

|
...
|
....
|
Dormir en refuge, un mode d’hébergement
écologique ?
Dans le cadre d’une démarche de développement durable, la
rénovation énergétique
du refuge de Bostan (Samoëns, Haute-Savoie) en 2016 s'est concrétisée
par
l'installation de panneaux solaires hybrides photovoltaïque/thermique.
Un poêle à
bois assure toujours le chauffage tandis que les 12 panneaux solaires
hybrides
photovoltaïque/thermique (8 panneaux au sud-est et 4 panneaux à
l’ouest)
produisent de l’électricité et de l’eau chaude pour le refuge.
L’installation sud-est est
active de 8 h du matin jusqu’à midi. De midi jusqu’à 15h les deux
installations sont
actives. Enfin, après 15h c’est l’installation orientée ouest qui prend
le relais jusqu'à
18 h.
1.1. Donner l’expression de la fréquence f d’un photon susceptible de provoquer
une variation d’énergie ΔE.
Calculer alors la longueur d’onde d’un photon qui fournit, par absorption,
une énergie DE égale à la valeur du gap de silicium (1,1 eV) et préciser si
cette radiation se situe dans le domaine visible.
ΔE = h f ; f = ΔE / h.
1,1 eV = 1,1 x1,6 10-19 =1,76 10-19 J.
f = 1,76 10-19 / (6,63 10-34) =2,65 1014 Hz.
l = c / f =3,0 108 /(2,65 1014)=1,13 10-6 m = 1,16 µm.
Cette radiation est dans le proche infrarouge.
1.2. L’installation du refuge de Bostan
1.2.1. À l’aide des caractéristiques physiques des panneaux, données
en début d’exercice, montrer que la valeur de la puissance
électrique maximale d’un panneau solaire est de 250 W pour un
ensoleillement de 1000 W.m-2
.
Puissance électrique fournie par 12 panneaux = 3,00 kW soit 3,00 / 12 =0,25 kW pour un panneau.
1.2.2. Calculer la valeur du rendement énergétique d’un tel panneau
solaire.
Surface d'un panneau : S =1,677 x 0,99 =1,66 m2.
Puissance solaire reçue : 1,66 x 1000 = 1660 W = 1,66 kW.
Rendement : 0,25 / 1,66 =0,15 ( 15 %).
1.2.3. Évaluer l’énergie électrique en kWh que l’on peut récupérer par
une belle journée d’été (pour un ensoleillement de 1000 W.m-2
)
en prenant en compte les durées de fonctionnement respectives
de chacune des deux installations Sud-Est et Ouest.
8 panneaux au sud ; durée de fonctionnement : 7 h; énergie produite : 0,25 x 8 x7 = 14 kWh.
4 panneaux à l'ouest ; durée de fonctionnement : 6 h; énergie produite : 0,25 x 4 x6 = 6 kWh.
Total : 20 kWh.
1.2.4. À partir des informations suivantes, discuter de la nécessité de la
présence d’un poêle à bois pour le chauffage.
Consommation moyenne par jour : 5 à 15 kWh minimum.
Un poêle à bois pour le chauffage est nécessaire.
2. Étude du poêle à bois.
Informations sur la combustion du bois.
Lors de sa combustion, le bois ne fait que libérer le dioxyde de carbone utilisé pour la
croissance de l’arbre dont il est tiré. Selon les règles de l’ADEME, les chauffages au
gaz, au fioul et à l’électricité émettent respectivement 222 kg, 480 kg et environ
180 kg de CO2 par MWh. Le bilan net pour le chauffage au bois est de 40 kg de CO2
émis par MWh.
Ainsi l’utilisation du bois permet de diviser les émissions de CO2 par 12 par rapport
au fioul et par 6 par rapport au gaz.
https://presse.ademe.fr/wp-content/uploads/2014/11/guide-pratique-se-chauffer-au-bois.pdf
Données :
- Bois : assimilé ici à de la cellulose de formule brute C6H10O5.
- Énergie libérée par la combustion, par kilogramme de bois (pouvoir
calorifique) : PC = 4,0 kWh.kg-1
;
2.1. Montrer que la quantité de matière de bois nécessaire à l'obtention d'une
d’énergie de valeur 1 MWh est proche de 1,5 x 103 mol.
Masse de bois : 1000 / 4,0 = 250 kg.
M(C6H10O5)=6 x12 +10 +5x16 =162 g / mol.
Quantité de matière de bois : 250 103 /162=1,5 x 103 mol.
2.2. Calculer alors la masse de dioxyde de carbone libérée lors de la
combustion du bois afin d’obtenir 1MWh d’énergie.
2C6H10O5 +17O2 --> 12CO2 + 10H2O.
6 x1,5 x 103 =9 103 mol de CO2.
9 103 xM(CO2) = 9 103 x44 =3,96 105 = 396 kg.
2.3. Expliquer pourquoi la valeur trouvée est très supérieure à celle donnée par
l'ADEME.
Expliquer l’intérêt écologique d’avoir installé un poêle à bois au refuge
plutôt qu’un autre système de chauffage (fioul ou gaz).
Le bois ne contient pas que de la cellulose.
Lors de sa combustion, le bois ne fait que libérer le dioxyde de carbone utilisé pour la
croissance de l’arbre
3. Aspect « thermique » des panneaux.
Les panneaux solaires thermiques fonctionnent grâce à un fluide caloporteur
(mélange eau-propylène glycol) qui y circule et est chauffé par le rayonnement
solaire. Cette énergie thermique est ensuite fournie au ballon d’eau chaude.
3.1. Recopier la formule semi-développée de la molécule de propylène
glycol et entourer les groupes caractéristiques. Nommer ce(s)
groupe(s).
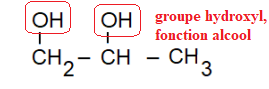
3.2. Expliquer pourquoi on ne peut pas utiliser l’eau pure comme fluide
caloporteur, notamment dans le cas d’un refuge de montagne et
préciser l’intérêt d’employer le propylène glycol.
L'eau pure gèle dès que la température descend en dessous de zéro degré Celsius.
Le propykène glycol est miscible à l'eau ; sa température de fusion est
très basse. La température de fusion du mélange eau propylène glycol
est abaissée.
|
|