Une horloge au jus d'orange.
Pour mettre en évidence le principe de fonctionnement d’une pile, il
est possible d’alimenter une horloge grâce à une pile rudimentaire
constituée d’une électrode de cuivre
et d’une électrode en magnésium plongeant dans du jus d’orange.
En réalisant l’expérience les valeurs suivantes sont relevées :
Durée de fonctionnement maximale Environ 21h.
Tension 1,52 V.
Intensité du courant électrique 0,3mA.
pH du jus d’orange au début et à la fin de
l’expérience Début : 3,9 Fin : 6,5.
Volume du jus d’orange 140 mL.
Le but de cet exercice est de modéliser le fonctionnement de
cette pile à l’aide d’un modèle mathématique en cohérence avec les
résultats expérimentaux mesurés.
Partie A :
étude de la pile.
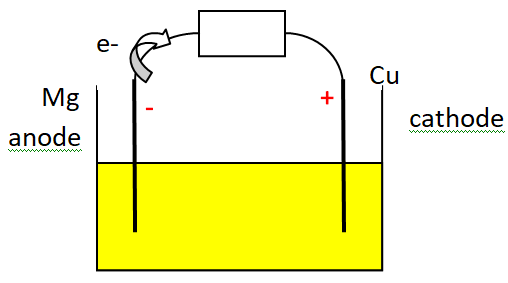
Lorsque cette pile rudimentaire est en fonctionnement, l’électrode en cuivre est le siège
d’une transformation chimique modélisée par la demi-équation électronique suivante :
2H
+(aq)+2e
− →H
2(g).
L’électrode en magnésium est quant à elle le siège d’une
transformation chimique modélisée par la demi-équation électronique :
Mg(s)→Mg
2+(aq) +2e
−.
1. Schématiser cette pile alimentant un dipôle (modélisant l’horloge) en indiquant le
sens de circulation des électrons et en identifiant clairement les deux électrodes.
Repérer sur le schéma l’anode et la cathode de cette pile.
 2.
2. À partir des deux demi-équations électroniques, écrire l’équation de la réaction
qui modélise le fonctionnement de la pile.
Mg(s)→Mg2+(aq) +2e−.
2H+(aq)+2e− →H2(g).
Addition : Mg(s) +2H+(aq)+2e−→Mg2+(aq) +2e−+ H2(g).
Simplifier : Mg(s) +2H+(aq)→Mg2+(aq) + H2(g).
3.
Utiliser l’équation de la réaction précédente pour expliquer
qualitativement l’évolution du pH du jus d’orange lorsque la pile
débite.
Les ions H
+ sont consommés, leur concentration diminue et le pH augmente.
On désire comparer la durée maximale de fonctionnement obtenue en utilisant la pile
au jus d’orange et celle que l’on aurait avec une pile LR6 standard achetée en magasin.
4. Une pile LR6 a une
quantité d’électricité stockée moyenne de 2 800 mAh. En admettant que
la pile LR6 débite un courant d’intensité identique à celle de la pile
à
jus d’orange, calculer la durée maximale de fonctionnement de l’horloge
alimentée par la pile LR6. En déduire le nombre de piles au jus
d’orange nécessaires pour
remplacer une pile du commerce.
Durée t = Q / I = 2 800 / 0,3 = 9,3 10
3 heures pour la pile LR6.
9,3 10
3 / 21 ~ 445 pile au jus d'orange.
Partie B : étude mathématique.
On note t le temps, exprimé en minute, écoulé depuis la mise en
fonctionnement de la
pile au jus d’orange.
À l’aide d’une étude expérimentale, la valeur du pH en fonction du
temps peut être modélisée par la fonction f définie sur [0 ;+∞[ par :
f (t) = 6,571−2,671exp(−
t
/ 261 ).
Une représentation graphique de f est donnée ci-dessous.
1. Calculer f (0). Interpréter ce résultat dans le contexte de l’expérience.
f(0) = 6,571 -2,671 = 3,9 ( pH initial du jus ).
2. a. Résoudre graphiquement l’équation f (t) = 5.
Donner le résultat en heure et minute.
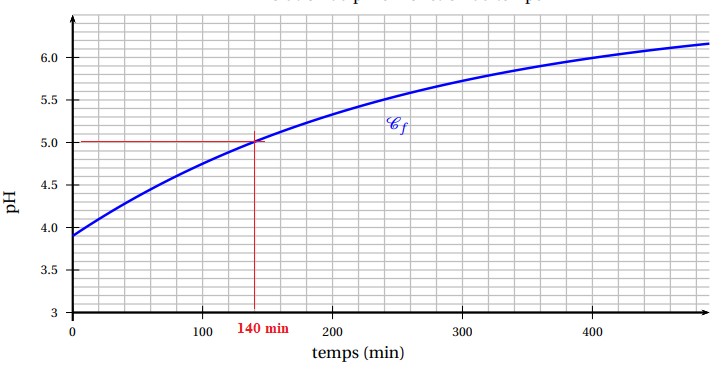
140 min = 2 h 20 min.
b. Résoudre algébriquement l’équation f (t) = 5. Donner le résultat arrondi à la
minute. Comparer ce résultat à celui obtenu à la question 2. a.
6,571−2,671exp(−
t
/ 261 ) = 5 ; 6,571-5 =1,571= 2,671exp(−
t
/ 261 ).
1,571 / 2,67 =0,588 ; ln(0,588) = -t / 261 ; 0,530 = t / 261 ; t ~138 min, en accord avec le graphe.
3. Calculer lim
t→+∞
f (t). Le résultat est-il compatible avec les valeurs relevées lors de
l’expérience ?
exp(−
t
/ 261 ) tend vers 0 si t tend vers + oo.
2,671exp(−
t
/ 261 ) tend vers 0 si t tend vers + oo.
pH tend vers 6,57, en accord avec l'expérience.