Le fluor 18, un traceur radioactif
.
Le fluor 18, noté
18F, est un isotope du fluor. Il est utilisé en médecine nucléaire comme
radio-traceur intégré dans des molécules de glucose modifiées. La solution de glucose
marqué au fluor 18 est injectée au patient pour l’examen.
La période radioactive (ou demi-vie) du fluor 18 vaut T½ = 110 min.
Il est le siège d’une désintégration radioactive de type β
+
.
On admet que la radioactivité de l’échantillon injecté devient inactive au bout de 20 périodes
radioactives (ou demi-vies) écoulées.
1. Définir l’expression « noyaux isotopes ».
Des noyaux isotopes ne diffèrent que par leur nombre de neutrons ; ils ont le même numéro atomique Z.
2. Donner la composition du noyau
189F d’un atome de fluor 18.
9 protons ; 18-9 = 9 neutrons.
L’équation de la réaction de désintégration nucléaire du fluor 18 s’écrit :
189F →
AZ X +
01e
+ γ
3. Donner le nom de la particule
01e émise par le fluor 18 lors de sa désintégration β
+
.
Positon.
4. Identifier parmi les noyaux suivants le noyau fils
AZ X
émis lors de la désintégration du
fluor
89F
. Justifier ce choix.
188O ;
198O ; 1910Ne ; 2010Ne.
Conservation du nombre de nucléons : 18 = A ;
conservation de la charge : 9 = Z+1 soit Z = 8. Donc
188O.
5. Donner la définition de la période radioactive (ou demi-vie) T
1/2 d’un radio-traceur.
Durée au bout de laquelle l'activité initiale est divisée par 2.
6. Déterminer le temps au bout duquel l’activité d’un échantillon de fluor 18 est divisée
par 8 par rapport à sa valeur initiale.
8 = 2
3 soit trois demi vie ou 3 x110 = 330 min.
7. L’activité initiale du produit injecté est de 400 MBq. Déterminer une valeur approchée de
l’activité résiduelle 12 heures et 50 minutes après l’injection, c’est-à-dire après 7 périodes
radioactives du fluor 18.
L'activité initiale est divisée par 2
7 =128.
400 / 128 ~3,1 MBq = 3,1 106 Bq.
8. L’activité radioactive naturelle du corps humain est de l’ordre de 120 Bq par kilogramme de
masse corporelle. Elle est due à l’ingestion d’aliments contenant naturellement des
éléments radioactifs. Justifier pourquoi il est conseillé au patient ayant subi l’examen
d’imagerie médicale d’éviter un contact étroit (de moins de 1 m) et prolongé (de plus de 30
minutes) avec toute personne pendant le reste de la journée.
Pour un patient de 60 kg : 120 x 60 =7200 Bq <
3,1 106 Bq due au fluor.
L'activité radioactive du patient est trop élevée.
Diagnostiquer des maladies avec un produit de contraste.
Un produit de contraste est une substance injectable ou ingérable utilisé en imagerie médicale
pour augmenter artificiellement le faible contraste naturel de certains tissus afin de
mieux visualiser les organes explorés. Pour certains types d’imagerie médicale, un produit de
contraste à base d’iode peut être utilisé.
La Gastrografine est un produit de contraste iodé dont le principe actif, l’ion amidotrizoate, est
la base du couple acide amidotrizoïque / ion amidotrizoate. La formule brute de l’acide
amidotrizoïque est C
11H
9
I
3N
2O
4
.
Sa formule topologique est donnée ci-dessous.
Dans un flacon de produit de contraste Gastrografine, la concentration en masse d’iode vaut
C
m = 370 g∙L
-1
. Ce produit de contraste est spécifique aux explorations gastro-intestinales.
La masse de produit de contraste à absorber dépend de la masse corporelle du patient.
La masse d’iode à absorber est de 500 milligrammes par kilogramme de masse corporelle du
patient.
1. Nommer les deux groupes caractéristiques entourés sur la formule de l’acide
amidotrizoïque.
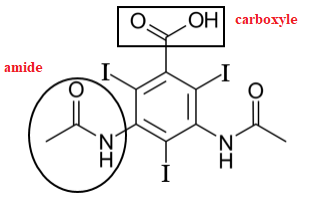 2.
2. Justifier le caractère acide de l’acide amidotrizoïque et écrire la formule brute de la base
associée.
La molécule possède une fonction acide carboxylique.
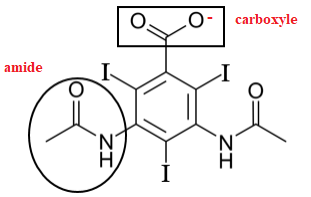 3.
3. Un patient de masse corporelle m = 73 kg doit réaliser un scanner nécessitant l’absorption
de Gastrografine.
3.1. Calculer la masse d’iode à donner au patient.
0,500 x 73 = 36,5 g d'iode.
3.2. En déduire le volume de Gastrografine à administrer et préciser si un flacon
commercial de 100 mL est suffisant.
Cm = 370 g∙L-1 soit 37 g dans 100 mL.
37 > 36,5 : un flacon commercial est suffisant.