Extraction du lithium.
La saumure extraite des lacs est une solution aqueuse qui contient différentes espèces
chimiques ioniques telles que le chlorure de sodium (Na
+
(aq) ; Cl
−
(aq)), le chlorure de
potassium (K
+
(aq) ; Cl
−
(aq)) en plus du chlorure de lithium (Li
+
(aq) ; Cl
−
(aq)).
Lors de l’évaporation d’une partie de l’eau contenue dans la saumure, on observe la
cristallisation de chlorure de sodium NaCl(s) et de chlorure de potassium KCl(s). La
saumure obtenue est alors plus concentrée en ions lithium Li
+
(aq).
Q1 - En utilisant les valeurs de solubilité données, expliquer pourquoi dans la saumure,
lors de l’évaporation d’une partie de l’eau :
- la concentration en ion Li
+
(aq) augmente ;
- les masses en ions K
+
(aq) et Na
+
(aq) diminuent.
La solubilité de LiCl est environ 3 fois supérieure à celle de NaCl et de KCl. Donc NaCl et Kcl vont précipiter (
les masses en ions K+
(aq) et Na+
(aq) diminuent ). Le volume de la solution diminue par évaporation ; la quantité de matière d'ion Li+ étant constante, sa concentration croït.
La saumure concentrée obtenue est ensuite traitée par dissolution de carbonate de sodium
Na
2CO
3(s).
Q2 - Écrire l’équation de la réaction qui modélise la dissolution du carbonate de sodium
Na
2CO
3(s) dans l’eau.
Na2CO3(s) --> 2Na+aq +CO32-aq.
On obtient alors la précipitation de carbonate de lithium Li
2CO
3(s). On observe aussi la
précipitation de chlorure de sodium NaCl(s).
Q3 - Écrire les équations des deux réactions de précipitation qui se produisent.
2Li
+aq +
CO32-aq --> Li2CO3(s).
Na+aq + Cl-aq --> NaCl(s).
La valeur de la concentration finale C
f en ions carbonate doit être au minimum de 60 g·L
–1
pour atteindre l’objectif de l’industriel : récupérer 90 % du lithium présent initialement dans
la saumure utilisée.
Protocole de titrage des ions carbonate dans la solution surnageante :
− un volume V
0 = 2,0 mL de solution surnageante, notée S
0, est placé dans une fiole
jaugée de 200 mL ;
− la fiole jaugée est complétée au trait de jauge avec de l’eau déminéralisée. La
solution obtenue est notée S
1 ;
− un volume V
1 = 5,0 mL de solution S
1 est dosé par titrage avec une solution d’acide
chlorhydrique (H
3O
+
(aq) ; Cl
−
(aq)) de concentration C
a = 1,0×10
–2 mol·L
–1
. Ce
dosage est suivi par pH-métrie après avoir ajouté de l’eau distillée pour que la sonde
du pH-mètre soit suffisamment immergée.
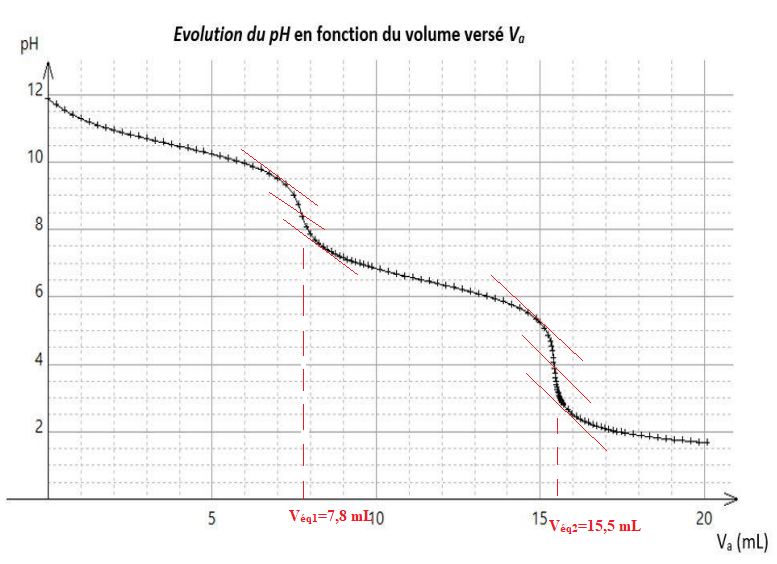
La courbe d’évolution du pH en fonction du volume versé V
a de solution acide est donnée.
Q4 - Sachant que l’acide conjugué de l’ion carbonate CO
3
2–
est l’ion hydrogénocarbonate
HCO
3
–
, qui est lui-même la base conjuguée du dioxyde de carbone dissous dans l’eau
(CO
2
,H
2O), écrire les deux couples acide/base faisant intervenir l’espèce amphotère
HCO
3
–
.
CO2
,H2O / HCO3
–
aq et HCO3
– aq /
CO3
2– aq.
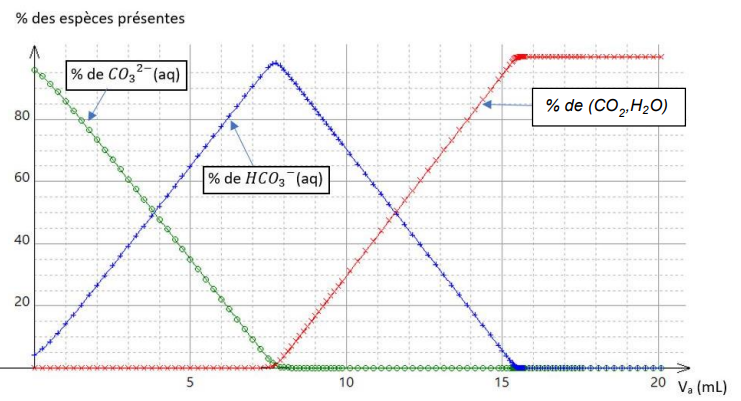
On donne ci-dessous le diagramme de distribution des espèces CO
3
2–
,
HCO3
–
et
(
CO2
,H2O) en fonction du volume versé V
a d’acide chlorhydrique.
 Q5
Q5 - À l’aide du diagramme de distribution fourni et des équations des réactions chimiques
impliquées, expliquer l’allure de la courbe de titrage obtenue.
Premier saut de pH :
CO3
2– aq + H3O+
(aq) --> HCO3
– aq +H2O(l). (1)
Second saut de pH : HCO3 – aq + H3O+
(aq) --> CO2
,H2O +H2O(l). (2)
Q6 - Montrer que, lorsqu’on atteint la deuxième équivalence, la relation entre la quantité
de matière d’ions carbonate n
CO3
2- en solution au début du dosage et la quantité de
matière d’ions oxonium n
H3O
+ versés jusqu’à la deuxième équivalence est :
2 × n
CO3
2- = n
H3O
+
.
Ajouter (1) et (2) CO3
2– aq + 2H3O+
(aq) --> CO2
,H2O +2H2O(l).
Au regard des coefficients stoechiométriques : 2 × nCO3
2- = nH3O
+
.
Q7 - En utilisant la courbe de titrage , déterminer le volume à l’équivalence V
eq2 correspondant au second
saut de pH.
 Q8
Q8 - À l’aide des questions précédentes, déterminer la valeur de la concentration en
quantité de matière C
1 de l’ion carbonate CO
3
2–
de la solution S
1.
nCO3
2- = nH3O
+ / 2 = 0,010 x15,5 10-3 / 2 =7,5 10-5 mol dans 5,0 mL soit 7,5 10-5 /(5,0 10-3) =1;5 10-2 mol / L.
Q9 - Montrer que la valeur de la concentration en masse C
m0 des ions carbonate de la
solution S
0 est comprise entre 90 et 100 g·L
–1
.
Tenir compte de la dilution au centième.
1;5 10-2 x100 = 1,5 mol / L.
M(carbonate) = 12 +3x16 = 60 g/mol.
Cm0 =60 x1,5 = 90 g / L.
Q10 - En déduire si l’ajout de carbonate de sodium à la saumure traitée a permis d’atteindre
l’objectif visé.
Cette valeur étant supérieure à 60 g /L, l'objectif n'est pas atteint.