La molécule d'acide ascorbique.
Cette partie traite de la synthèse et de l’analyse de l’acide
ascorbique.
Le jus d’oranges pressées est apprécié par les consommateurs pour sa
teneur en acide L-ascorbique, connu
sous le nom de vitamine C.
1.1. Donner le nom de la
fonction chimique entourée sur la formule semi-développée de la
molécule d’acide
L-ascorbique donnée ci-dessous.
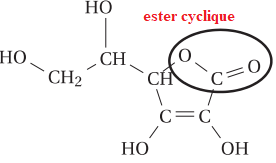
L'acide
L-ascorbique peut être synthétisé en plusieurs étapes à partir du
D-glucose. L’étape 2 décrite est une étape biologique.
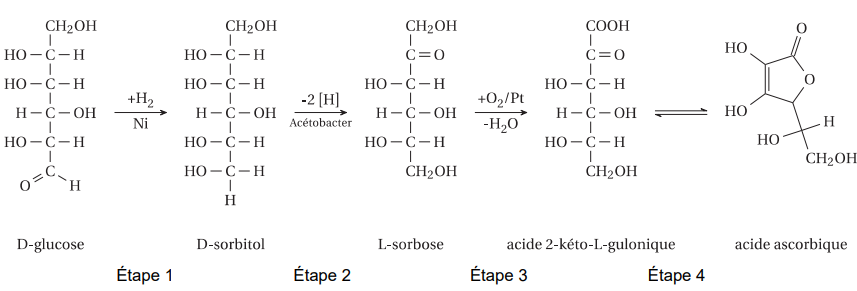 1.2.
1.2. Nommer la fonction chimique qui disparaît et celle qui apparaît lors de l’étape 1.
Réduction de la fonction aldehyde en alcool primaire.
Lors de l’étape 4, la fonction acide carboxylique de l’acide 2-kéto-L-gulonique réagit avec une de ses
fonctions alcool.
1.3. Choisir le nom de cette réaction dans la liste suivante : oxydation,
estérification, hydrolyse,
saponification.
1.4. Donner le nom de l’espèce produite en même temps que l’acide ascorbique.
H
2O.
1.5. Sachant que la production annuelle mondiale d’acide ascorbique est de 80 000 tonnes, déterminer la
valeur de la quantité de matière n
a d’acide ascorbique produit annuellement.
M( acide ascorbique) =176 g / mol.
n
a = 80 000 x 10
6 / 176 =4,54 10
8 mol.
1.6. Sachant qu’une mole de glucose produit une mole d’acide ascorbique et que le rendement de la
synthèse est de 60 %, déterminer la valeur de la masse m
G de glucose nécessaire.
4,54 108 x M(glucose ) / 0,60 =4,54 108 x 180 / 0,60 =1,36 1011 g ou 1,36 105 tonnes.
1.7. Recopier la formule de l’acide L-ascorbique donnée dans la question 1.1. et indiquer les atomes de
carbone asymétrique par une étoile *. En déduire le nombre de stéréoisomères de configuration que
possède la molécule d’acide ascorbique.
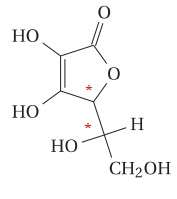
Donc 4 stéréoisomères.
L’acide L-ascorbique est la seule molécule à pouvoir s’appeler vitamine C. C’est l’isomère naturellement
présent dans les fruits et les légumes (E300). Il peut être synthétisé seul par la méthode étudiée
précédemment, ou par un autre procédé, qui donne alors un mélange racémique composé à 50 % d’acide
L-ascorbique et à 50 % d’acide D-ascorbique.
 1.8.
1.8. Justifier que les acides L-ascorbique et D-ascorbique sont énantiomères.
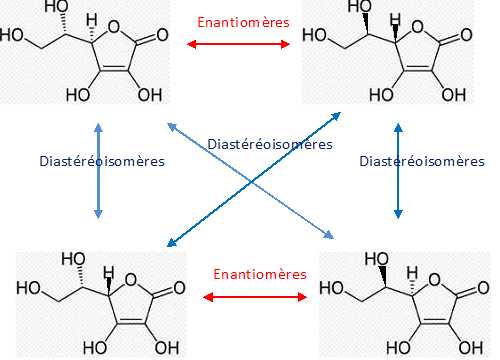 1.9.
1.9. Justifier qu’on ne peut pas différencier les acides L-ascorbique et D-ascorbique par leur spectre infrarouge.
Les deux molécules possèdent les mêmes groupes fonctionnels.
L’indice de réfraction est une grandeur physique caractéristique d’une substance.
Pour la suite, on prendra l’indice de réfraction de l’acide L-ascorbique n
D
25 = 1,51.
Dans la notation n
D
25, l’exposant et l’indice signifient que la mesure est réalisée à 25 °C, avec le doublet de
raies D du sodium. Les longueurs d’onde des raies de ce doublet sont si proches qu’on ne les distingue pas.
1.10. Définir par une phrase l’indice de réfraction en utilisant la notion de célérité.
Indice de réfraction d'une substance = célérité de la lumière dans le vide / célérité de la lumière dans cette substance.
1.11. Le doublet de raies D du sodium est-il dans le spectre visible ? Justifier.
l = 590 nm appartient au spectre visible [400 ; 800 nm].
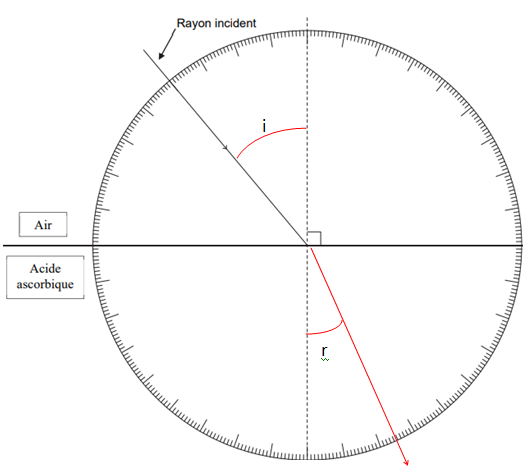
1.12. Compléter le document en effectuant les tâches suivantes :
• repérer l’angle incident i avec un arc de cercle, et donner sa mesure en degrés en s’aidant du
cercle trigonométrique tracé sur la figure ;
• calculer la valeur de l’angle de réfraction r ;
• tracer le rayon réfracté ;
• repérer l’angle de réfraction r avec un arc de cercle.
sin r = sin i /
nD
25 =sin 40 / 1,51 =0,426 ; r = 25,2°.
 1.13
1.13. Pourrait-on distinguer l’acide L-ascorbique de l’acide D-ascorbique par la mesure de leur indice de
réfraction ? Justifier.
Non, les propriétés physiques et chimiques de deux énantiomères sont identiques sauf le pouvoir rotatoire.
Ces deux molécules, mises en solution, ont un pouvoir rotatoire spécifique différent. Pour faire
expérimentalement la différence entre elles, on pourra donc utiliser un polarimètre.
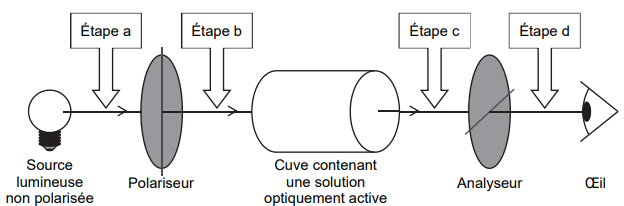
Les orientations du polariseur et de l’analyseur croisés sont orthogonales. Dans ces conditions, en l’absence
de solution optiquement active, aucune lumière n’émerge du polarimètre.
1.14. Donner la nature physique des ondes lumineuses.
Ondes électromagnétiques.
1.15. Indiquer l’état de polarisation dans l’étape b.
A la sortie du polariseur, la lumière est polarisée linéairement.
1.16. Indiquer ce que l’on observe dans l’étape d si la cuve contient un mélange racémique. Justifier.
Les deux énantiomères étant présents en quantité égale, aucune lumière ne sort du polarimètre.