La
biomasse pour remplacer le pétrole, bac SPCL Polynésie
2022.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
Le sujet traite de la production de HMF à
partir de glucose, aux échelles du laboratoire puis
industrielle, et du choix d'une méthode d'analyse de cette matière
première.
Étude de la transformation du glucose en HMF à l'échelle du laboratoire.
Le glucose peut être déshydraté en HMF (5-hydroxyméthylfurfural).
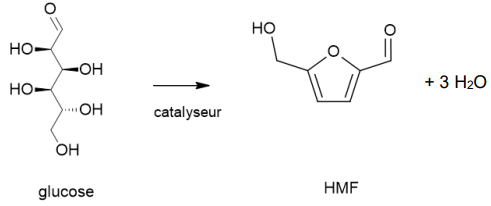
La réaction est étudiée au laboratoire dans les conditions ci-dessous :
- dans un ballon contenant de l’acide chlorhydrique saturé en chlorure de sodium, on
dissout le glucose et on ajoute le solvant organique SBP (2-secbutylphenol) ;
- on ajoute un catalyseur et la solution est agitée et chauffée ;
- après refroidissement, la phase organique contenant l’espèce chimique HMF est
séparée du milieu réactionnel puis analysée ;
- on vérifie la nature du produit obtenu par spectroscopie infra-rouge.
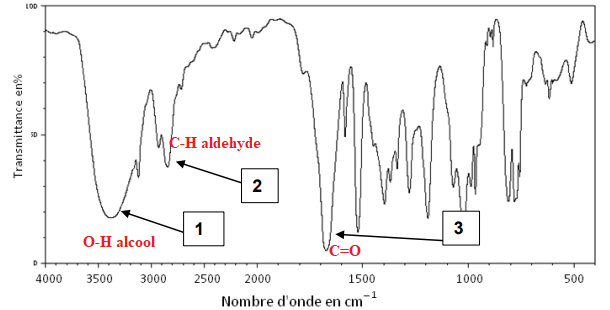
On donne ci-dessous le spectre infra-rouge de la molécule de HMF.
1.1. En utilisant la table spectroscopique simplifiée infra-rouge ci-après, identifier les
fonctions associées aux trois raies numérotées de 1 à 3 sur le spectre infra-rouge de
la molécule de HMF.
Dans un premier temps, afin de comprendre cette réaction de déshydratation, on l’étudie
sur un alcool plus simple : le butan-2-ol.
Le mécanisme réactionnel de la déshydratation du butan-2-ol en milieu acide est décrit
ci-après.
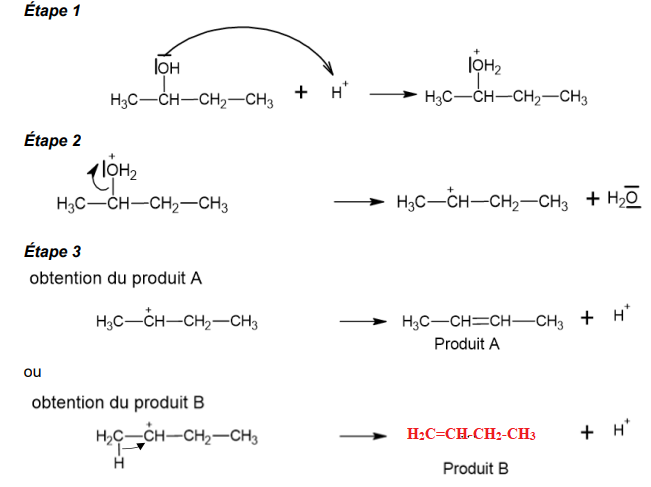
1.2. Identifier le catalyseur utilisé lors de la déshydratation du butan-2-ol.
Un acide fort donnant des ion H+.
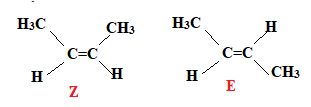
1.3. Le produit A existe sous forme de deux diastéréoisomères de type Z et E. Les
représenter par leur formule développée.
1.4. Reproduire l'étape 3 du mécanisme réactionnel et compléter par
une ou des flèches courbes expliquant la formation du produit A.
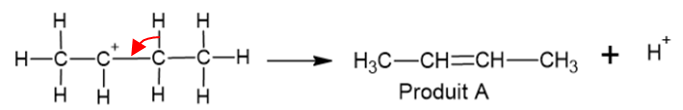
1.5. Lors de l'étape 3 du mécanisme de la déshydratation du butan-2-ol, le carbocation
peut conduire à une molécule B. Représenter sur votre copie la formule semi-développée
de la molécule B. ( Voir ci-dessus).
Dans un second temps, on s’intéresse à l'optimisation de la déshydratation du glucose en
HMF. Pour cela, la même transformation du glucose en HMF à l’échelle du laboratoire est
réalisée avec quatre catalyseurs différents :
Les évolutions de la quantité de matière de glucose et de HMF au cours du temps sont
mesurées pour ces quatre catalyseurs. Les graphiques suivants
représentent l’évolution de la quantité de matière, en μmol, de glucose et
de HMF au cours du temps.
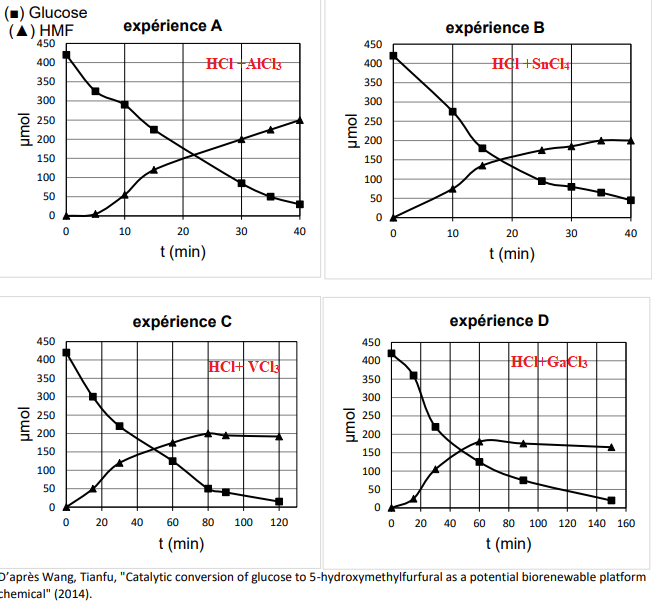
1.6. Parmi les expériences A, B, C ou D, choisir le catalyseur qui a été le plus efficace au
bout de 40 min pour la production du HMF en justifiant le choix.
Exprience A. Au bout de 40 min, il s'est formé 250 µmol de HMF.
1.7. Pour l’expérience retenue, déterminer le rendement de la transformation du glucose en
HMF au bout de 40 minutes.
250 / 420 ~ 0,60 (60 %).
Vers un procédé industriel de production.
La synthèse industrielle du HMF est réalisée dans un réacteur à double enveloppe dans
laquelle circule de l’huile (fluide caloporteur). Dans le réacteur, le mélange réactionnel est
maintenu à la température de 170 °C.
La réaction s’effectue en continu, une solution de glucose est injectée en continu dans le
réacteur et le HMF, supposé pur, est extrait en fond de réacteur. La masse de mélange
contenu dans le réacteur doit être maintenue constante.
1.8. Justifier la nécessité de contrôler le procédé par au moins deux boucles de régulation
sur le réacteur dont la grandeur réglée de chacune sera précisée.
La température et la masse du mélange ( c'est à dire les débits massiques ) doivent être régulées.
1.9. En étudiant le schéma de principe de la synthèse en continu du HMF ci-après,
indiquer sur votre copie le nom des espèces chimiques intervenant dans la synthèse
contenue dans chaque flux de matière symbolisés par les lettres A, B et C.

La masse dans le réacteur est maintenue constante, entrainant la conservation des débits
massiques entre l’entrée et l’ensemble des sorties. Le débit massique d’eau éliminé, Qme ,
est de 96,5 kg h
-1 et le débit de solution aqueuse de glucose injecté sous pression, Qmg ,
est de 100,0 kg h
-1
.
1.10. Déterminer le débit massique QmHMF de HMF produit.
Conservation de la matière : QmHMF = Qmg -Qme =100,0 -96,5 =3,5 kg h-1.
1.11. La masse volumique du HMF est de 1,24 kg L
-1
, en déduire que la valeur du débit
volumique de HMF est d’environ 2,8 L h
-1
.
3,5 / 1,24 =2,8 L h-1.
La température dans le réacteur est mesurée par un capteur-conditionneur étalonné en
laboratoire pour délivrer un signal en tension 0-10 V pour une échelle de température 100-
200°C. La partie capteur est une sonde résistive « Pt100 » couramment employée dans
l’industrie. La valeur de la résistance lue dans des tables pour la température de 170 °C
vaut 164 ohms.
1.12. Déterminer la sensibilité du capteur-conditionneur en V°C-1
.
10 / (200-100)=0,1 V °C-1.
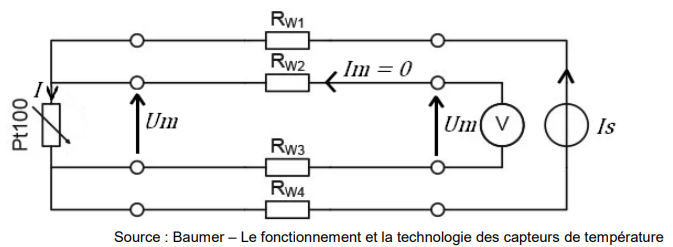
Un montage classique comporte 4 fils entre le conditionneur et le capteur. Le conditionneur
génère un courant faible Is = 10,0 mA qui est envoyé vers la résistance Pt100 par le fil de
résistance Rw1 et revient par celui de résistance Rw4. Le conditionneur mesure la tension
Um aux bornes des deux autres fils. Le courant qui parcourt les résistances Rw2 et Rw3 est
quasi nul.
1.13. En appliquant la loi des nœuds, déterminer la valeur du courant I parcourant la
résistance Pt100.
I = Im +Is = 0 +10,0 = 10,0 mA.
1.14. Déterminer la valeur de la tension Um mesurée par le conditionneur pour une
température de 170 °C dans le réacteur.
Um = 164 x10,0 10-2 = 1,64 V.
|
...
|
....
|
: Préchauffage du glucose dans un échangeur
[Echanges thermiques - Echangeurs en régimes stationnaires]
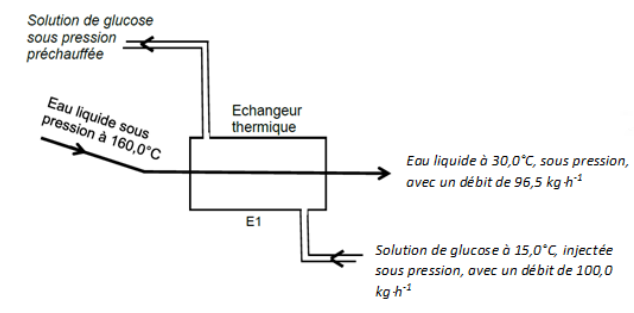
La synthèse du HMF est réalisée dans un réacteur. Le glucose injecté en continu dans le
réacteur est préchauffé dans un échangeur thermique E1.
L’échangeur E1 est supposé sans pertes thermiques. Le schéma ci-dessous détaille les
fluides avec leurs températures et débits.
Données : capacités thermiques massiques à 25°C :
- solution de glucose, cg = 4,00 kJ kg-1 °C-1
;
- eau, ceau = 4,18 kJ kg-1 °C-1
.
A.1. Montrer que la puissance thermique cédée par l’eau est de 14,6 kW.
Peau = débit massique x ceau x différence de température.
Peau =96,5 /3600 x 4,18 x(160-30,0)=14,6 kW.
A.2. Justifier alors que la puissance reçue par la solution de glucose soit égale à 14,6 kW.
L’échangeur E1 est supposé sans pertes thermiques.
A.3. Déterminer la température de la solution de glucose à la sortie de l’échangeur E1
(température de préchauffage).
Pglucose = débit massique x cg x différence de température = 14,6 kW.
14,6 =100 /3600 x 4,00 x(Tfin-15,0).
14,6 =0,111 Tfin-15,0). Tfin-15,0)=131,4 ; Tfin = 146 °C.
La puissance échangée dans un échangeur a pour expression :
𝑃 = 𝐾 × 𝑆 × Dqmoy.
Dqmoy : écart moyen de température entre les deux fluides ;
- K : coefficient global d’échange, dépendant du type d’échangeur, en W m-2 °C-1
;
- S : surface d’échange entre les fluides.
Elle dépend du nombre de plaques
constituant l’échangeur.
Pour l’échangeur étudié, Dqmoy.= 14,5 °C et K = 3,1 kW m-2 °C-1
. On se propose de
déterminer le nombre de plaques le constituant.
Le profil des températures des fluides dans l’échangeur est donné ci-dessous.
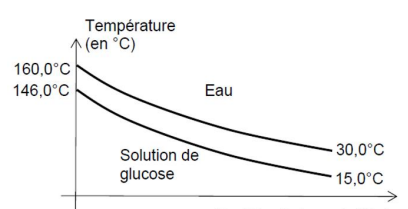
A.4. En justifiant la réponse, indiquer si l’échangeur est à co-courant ou à contre-courant.
Dans un échangeur à contre-courant la température de sortie d'un fluide tend vers la température de sortie de l'autre fluide.
Or l'écart de température augmente de 14°C à 15°C, donc échangeur co-courant.
A.5. Déterminer le nombre de plaques nécessaires dans l’échangeur sachant que la
puissance thermique échangée est de 14,6 kW.
14,6 = 3,1 x 14,5 S.
S = 14,6 / (3,1x14,5)=0,32 m2.
Surface d'une plaque 0,032 m2 ; donc 10 plaques.
|
|