L’objectif de cet
exercice est d’étudier le fonctionnement d’une pile réalisée au
laboratoire et de comparer sa capacité électrique à celle d’une pile AA
vendue dans le
commerce.
Masses molaires :
espèce chimique Al : 27 g /mol ; Al
2(SO
4)
3
: 342,15 g /mol.
Couples oxydants-réducteurs : (Cu
2+(aq) / Cu(s)) et
(Aℓ
3+(aq) / Aℓ(s)) ; 1 mAh = 3,60 C.
Pour réaliser la pile étudiée, deux solutions aqueuses sont
préparées : une de sulfate d’aluminium notée S, et
une de sulfate de cuivre (Cu
2+(aq) ; SO
4
2–(aq), notée S’, toutes les deux sont à la concentration en soluté
apporté de C = 0,100 mol·L
-1. Le sulfate d’aluminium est un solide de
formule Aℓ
2(SO
4)
3(s), disponible sous
forme de poudre.
1. Rédiger le protocole expérimental précis à mettre en œuvre pour
préparer 50,0 mL de la solution S à partir
du sulfate d’aluminium en poudre.
Quantité de matière : 50,0 10
-3 x0,100 =5,00 10
-3 mol.
Masse à peser sur une balance de précision : 5,00 10
-3 x 342,15=1,71 g.
Verser le solide dans une fiole jaugée de 50,0 mL contenant un tiers d'eau distillée.
Agiter jusqu'à dissolution complète.
Compléter jusqu'au trait de jauge avec de l'eau distillée.
Agiter pour rendre homogène.
2. Calculer les concentrations en quantité de matière en ions aluminium
Aℓ
3+(aq) et en ion sulfate SO
4
2–(aq)
dans la solution S.
[
Aℓ
3+(aq)]=2C = 0,200 mol / L.
[
SO4
2–(aq)] =3 C = 0,300 mol / L.
La pile est assemblée selon le schéma représenté
ci-dessous.
Pour déterminer la polarité de la pile ainsi constituée, un voltmètre est relié aux deux plaques métalliques. La
borne COM du voltmètre est reliée à la plaque d’aluminium. Dans ces conditions, la tension mesurée aux
bornes de la pile vaut U = 0,92 V.
3. Déterminer le pôle positif de la pile à l’aide du montage expérimental.
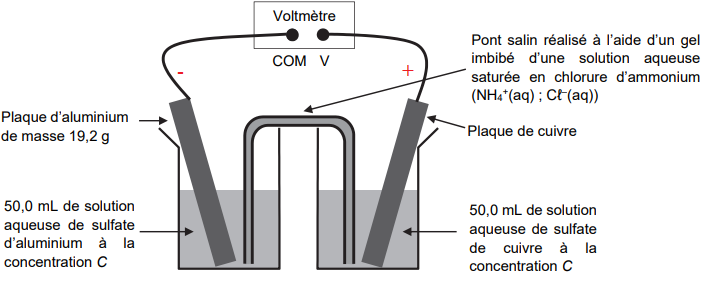
.