Des
piles historiques,
bac Métropole 2022.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
.
.
|
..
..
......
...
|
Le physicien italien Alessandro Volta a créé la première pile en 1799 ;
elle était formée d’un empilement
de disques métalliques. Quarante ans plus tard, le chimiste anglais
John Daniell propose un nouveau type
de pile permettant de pallier certains défauts de la pile Volta.
L’objectif de cet exercice est d’étudier le
fonctionnement de ces deux piles
Une pile Volta est réalisée en
empilant successivement des « cellules élémentaires ». Chaque
cellule élémentaire est constituée d’une rondelle de cuivre, d’une
rondelle de matériau absorbant imbibé
de solution aqueuse contenant des ions et d’une rondelle de zinc.
Couples oxydant / réducteur mis en jeu dans la pile Volta : Zn2+(aq)
/ Zn(s), H+(aq) / H2(g).
Au laboratoire, on réalise une cellule élémentaire avec une rondelle de
cuivre, une rondelle de feutre (sorte
de tissu épais) imbibée d’une solution d’eau salée (les cations seront
par la suite notés ⊕ et les anions )
et une rondelle de zinc. Lorsque la cellule est reliée à un conducteur
ohmique de résistance d’une dizaine
d’ohms, on observe un dégagement gazeux. Pour la suite, on considère
que le cuivre est inerte, c’est-àdire qu’il ne subit pas de
transformation chimique.
Q1. Justifier que
l’équation modélisant la transformation chimique ayant lieu lorsque la
cellule débite s’écrit :
Zn(s) + 2 H+(aq) → Zn2+(aq) + H2(g).
Q2. En déduire
quelle électrode, parmi celle en zinc et celle en cuivre, joue le rôle
de cathode. Justifier.
Oxydation du zinc à l'anode négative: Zn
(s) --> Zn2+aq + 2e-.
Réduction des ions H+aq à la cathode posiitive.
2H+aq + 2e- --> H2(g).
On additionne ces deux demi-équations et on simplifie :
Zn(s) + 2 H+(aq) → Zn2+(aq)
+ H2(g).
Q3. Compléter le schéma
en indiquant les pôles de la cellule,
le mouvement des électrons, le mouvement des cations ⊕ et des anions
dans la rondelle de feutre et le
sens conventionnel du courant d’intensité I.
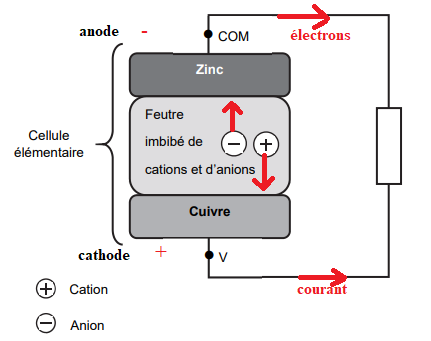
Pour compenser l'apparition des cations Zn2+ au niveau du
zinc et respecter l'électroneutralité des anions arrivent.
Pour compenser la disparition des cations H+
au niveau du cuivre et respecter l'électroneutralité des cations
arrivent.
On mesure
la tension U aux bornes de cette cellule élémentaire en reliant la
borne « V » du voltmètre à
l’électrode de cuivre et la borne « COM » à l’électrode de zinc. On lit
U = 0,82 V.
Q4. Justifier la
cohérence du signe de cette mesure avec les réponses données
précédemment.
La borne COM du voltmètre doit être reliée à la bone négative de la
pile, c'est à dire le zinc.
La tension délivrée par une cellule élémentaire étant trop faible pour
certaines expériences, Volta a réalisé
sa pile en associant plusieurs cellules élémentaires.
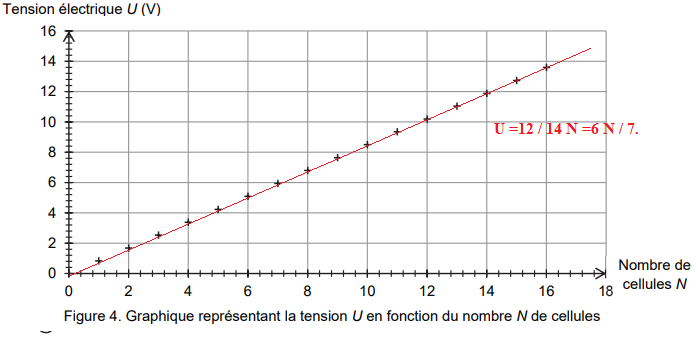
On souhaite étudier l’évolution de la tension électrique délivrée par
l’ensemble des cellules en fonction du
nombre de cellules constituant le système. Ainsi, on réalise plusieurs
mesures de tension U aux bornes
d’un ensemble de N cellules, associées en série, en modifiant le nombre
N de cellules. Les résultats sont
donnés.
Proposer une relation numérique entre la
tension U et le nombre N de cellules.
 .
Q6. En supposant que la relation
précédente est valable quel que soit le nombre de cellules élémentaires
mises en série, déterminer l’ordre de grandeur du nombre de cellules
élémentaires nécessaires à
l’obtention d’une tension d’une centaine de volts. .
Q6. En supposant que la relation
précédente est valable quel que soit le nombre de cellules élémentaires
mises en série, déterminer l’ordre de grandeur du nombre de cellules
élémentaires nécessaires à
l’obtention d’une tension d’une centaine de volts.
N = 7 U / 6 =700 / 6 ~117.
2. La pile Daniell
Le gaz qui se forme lors de l’utilisation de la pile Volta empêche la
production d’un courant constant au
cours du temps, nécessaire pour l’alimentation de certains appareils
électriques, comme le télégraphe.
Progressivement, la pile Daniell remplace les piles basées sur le
principe de Volta. Elles peuvent être
associées en série pour augmenter la tension globale délivrée.
On peut schématiser une pile Daniell de la manière suivante :
- une électrode en cuivre plonge dans un volume V = 100 mL de solution
aqueuse de sulfate de
cuivre (Cu2+(aq) ; SO4
2–(aq)) de concentration C = 0,100 mol·L–1,
cette solution étant elle-même
contenue dans un vase poreux ;
- le vase poreux joue le rôle de pont salin ;
- le vase poreux plonge dans un bécher contenant une solution acide et
une électrode de zinc de
masse d’environ m ≈ 100 g.
L’équation modélisant la transformation chimique ayant lieu lorsque la
pile Daniell débite un courant est :
Cu2+(aq) + Zn(s) → Cu(s) + Zn2+(aq)
Données : masse molaire du sulfate de cuivre CuSO4 :
159,6 g·mol–1 ;
masse molaire du zinc Zn : 65,4 g·mol–1 ;
charge électrique d’une mole d’électrons : 9,65×104 C.
Q7. Montrer que l’ion Cu2+
est le réactif limitant dans la transformation considérée.
n(Cu2+) =0,100 x 0,100 =1,0 10-2 mol.
n(Zn) =100 / 65,4 ~1,5 mol en large excès.
Q8. En supposant que la
pile soit destinée à l’alimentation d’un appareil nécessitant un
courant électrique
d’intensité 20 mA, déterminer la valeur de la durée maximale de
fonctionnement de la pile.
Quantité de matière
d'électrons : Cu2+(aq) +2e- -->
Cu(s).
n(e-) =2 n(Cu2+)
=2,0 10-2 mol.
Quantité d'électricité : Q = n(e-)
F =2,0 10-2 x 9,65×104 =1,93 103
C.
Q = I t ; t = Q / I =1,93 103 / 0,020 =9,65 104 s
ou environ 26 heures 48 minutes..
|