Encre
et effaceur,
bac Métropole 2022.
Loi de Beer-Lambert ; oxydoréduction
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
.
.
|
..
..
......
...
|
Le but de cet exercice est d’étudier la composition d’une encre de stylos plume avant de déterminer le
nombre de cartouches qui peuvent être effacées avec un effaceur.
1. Encre des stylos plume.
Afin de déterminer la quantité de bleu d’aniline présente dans une cartouche, on souhaite réaliser un
dosage spectrophotométrique.
Pour rester dans le domaine de validité de la loi de Beer-Lambert, l’encre d’une cartouche est diluée.
Protocole suivi :
- aspirer la totalité de l’encre de la cartouche à l’aide d’une seringue équipée d’une aiguille ;
- introduire l’encre récupérée dans une fiole jaugée de volume V1 = 100 mL et compléter avec de
l’eau distillée : on note S1 la solution ainsi préparée ;
- préparer un volume V2 = 100 mL d’une solution S2 en diluant 20 fois la solution S1 ;
- mesurer l’absorbance de la solution S2 pour différentes valeurs de longueur d’onde. Les résultats
des mesures sont reportés sur la figure suivante.
Q1. Montrer que le spectre d’absorption obtenu est en accord avec la couleur de l’encre.
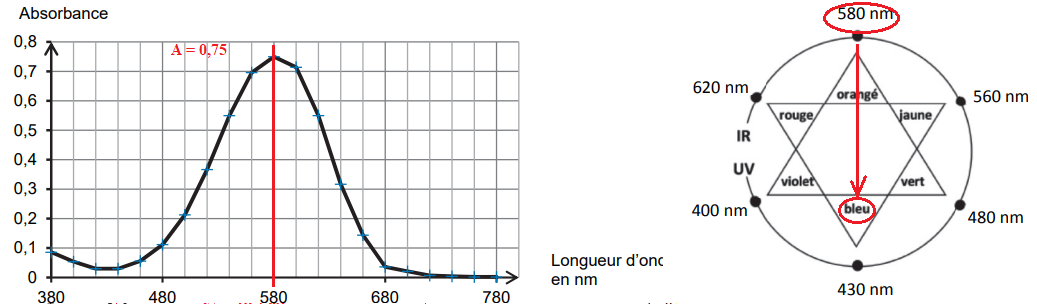
L'encre présente un maximum d'absorption vers 580 nm ( orangé). L'encre
possède la couleur complémentaire del 'orangé, c'est à dire le bleu.
Q2. Nommer la verrerie nécessaire à la préparation par dilution de la solution S2, en précisant les volumes.
Fiole jaugée de 100,0 mL.
Facteur de dilution F = 20.
Pipette jaugée de 100 / 20 = 5,0 mL.
Q3. Déterminer, en utilisant la loi de Beer-Lambert, la concentration en quantité de matière
en bleu d’aniline de la solution S2.
A = e l C.
e =5,00 104 L mol-1 cm-1 ; l = 1,0 cm.
C = 0,75 / (5,00 104 x1,0 )=1,5 10-5 mol / L
Q4. Montrer que la quantité de matière de bleu d’aniline présente dans une cartouche d’encre est environ
égale à 3,0×10–5 mol.
n = 1,5 10-5 x 0,10 =1,5,0 10-6 mol dans S2.
1,5,0 10-6 x 20 =3,0 10-5 mol dans S1.
Q5. Calculer le titre massique en bleu d’aniline de l’encre contenue dans la cartouche. Conclure.
M( bleu d'aniline) = 737,7 g / mol.
m (bleu) = 3,0 10-5 x737,7 =2,21 10-2 g.
Volume de la cartouche d'encre 0,60 mL ; masse volumique de l'encre 1,1 g / mL.
Masse d'encre : 0,60 x1,1 =0,66 g.
Titre massique : 2,21 10-2 /0,66 ~3,4 10-2 ( 3,4 %).
Valeur en accord avec "L’encre ne contient que 3 à 5 % en masse de ce colorant "
2. Effaceur d’encre.
Le côté blanc d’un effaceur est constitué d’une mine reliée à un réservoir contenant une solution d’ions
sulfite SO3
2– qui sont responsables de l’effacement de l’encre.
On cherche dans cette partie à déterminer la quantité de matière d’ions sulfite présente dans l’effaceur à
l’aide d’un titrage par une solution de diiode de concentration C = 1,0×10–2 mol∙L–1.
Protocole du titrage de la solution contenue dans l’effaceur :
- casser l’effaceur en son milieu pour récupérer le réservoir et la mine blanche contenant la solution
d’ions sulfite ;
- les placer dans un bécher avec un peu d’eau ;
- mélanger, attendre quelques minutes puis retirer le réservoir et la mine en veillant à bien les
essorer : la solution obtenue est notée S ;
- mesurer le pH de la solution S ;
- placer le bécher sous une burette graduée contenant la solution de diiode puis réaliser le titrage
de la solution.
La valeur mesurée du pH de la solution S est 11,0. Le volume de solution de diiode versé à l’équivalence
du titrage est égal à VE = 8,2 mL.
Q6. À l’aide d’un diagramme de prédominance, justifier que l’ion sulfite SO3
2– est majoritaire par rapport à
HSO3
– et SO2,H2O dans la solution S.
pKa à 25 °C des couples acide / base :
- SO2,H2O(aq) / HSO3
–
(aq) : pKA1 = 1,8 ;
- HSO3
–
(aq) / SO3
2–(aq) : pKA2 = 7,0 ;
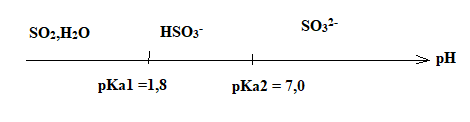
L’ion sulfite SO3
2– est majoritaire à pH = 11 > pKa2, de la solution S.
Q7. Écrire l’équation de la réaction d’oxydoréduction support du titrage en milieu basique entre les ions
sulfite SO3
2– et le diiode I2.
Oxydation de l'ion sulfite : SO3
2–aq +2HO-aq ---> SO3
2–aq + H2O (l) +2e-.
Réduction du ssiode I2aq +2e-.--> 2I-aq.
Ajouter et simplifier : SO3
2–aq +2HO-aq + I2aq---> SO3
2–aq + H2O (l) +2I-aq.
Q8. Montrer que la quantité de matière d’ion sulfite n1 contenue dans un effaceur est voisine
de 8×10–5 mol.
n1 = VE C = 8,2 x1,0 10-2 =8,2 10-2 mmol = 8,2 10-5 mol.
Q9. En déduire le nombre de cartouches d’encre que l’on peut effacer avec un seul effaceur en supposant
que la réaction d’oxydoréduction entre le bleu d’aniline et les ions sulfite met en jeu une mole de bleu
d’aniline pour une mole d’ions sulfite.
La quantité de matière de bleu d’aniline présente dans une cartouche d’encre est environ
égale à 3,0×10–5 mol.
8,2 / 3 ~2,7 ( environ 3 ) cartouches d'encre.
|