Acide
méthanoïque, Bac Métropole 9 /9 / 2022.
Acide base, synthèse du méthanoate d'éthyle.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
Sur
l’étiquette du flacon de l’acide méthanoïque concentré commercial
utilisé, on lit que le titre
massique minimum est de 85 %. La densité mesurée de ce produit est
mesurée, elle vaut 1,19.
1. Propriétés acido-basiques de
l’acide méthanoïque.
Pour étudier les propriétés acido-basiques de l’acide méthanoïque, une
solution aqueuse d’acide
méthanoïque, notée S, est préparée à partir de 1,0 mL d’acide
méthanoïque concentré commercial dilué dans
une fiole jaugée de 250 mL.
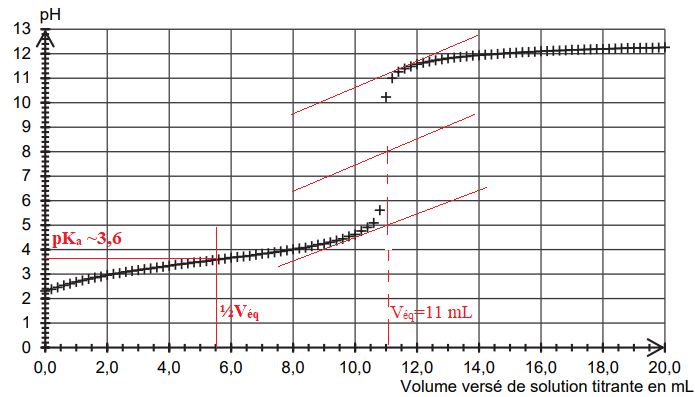
Le titrage d’un volume V = 25,0 mL de solution S est réalisé et suivi
par pH-métrie. La solution titrante est une
solution aqueuse d’hydroxyde de sodium de concentration cB
égale à 0,20 mol·L–1. La courbe du suivi pHmétrique est
donnée.
Q1. Écrire
l’équation de la réaction support du titrage.
HCOOH aq + HO-aq --> HCOO-aq + H2O(l).
Q2. Déterminer la
valeur de la concentration en quantité de matière d’acide méthanoïque
présent dans la
solution S.
n = CB Véq = 0,20 x 11 10-3 =2,2 10-3
mol dans 25 mL de solution S.
Soit pour la solution S : 2,2 / 25 =0,088 mol / L.
Solution commerciale : 0,088 x 250 =22 mol / L
Q3. En
déduire la valeur du titre massique d’acide méthanoïque de la bouteille
utilisée. Commenter.
22 x M(HCOOH )= 22 x 46 =1,01 103 g / L.
Concentration massique d'après les données de l'étiquette : 1,19 x 0,85
=1,01 kg / L.
Les résultats concordent.
On utilise les valeurs de pH mesurées au cours de ce titrage pour
déterminer si l’acide méthanoïque peut être
considéré comme un acide fort ou un acide faible. L’exploitation des
mesures de pH permet d’obtenir la
figure ci-dessous :
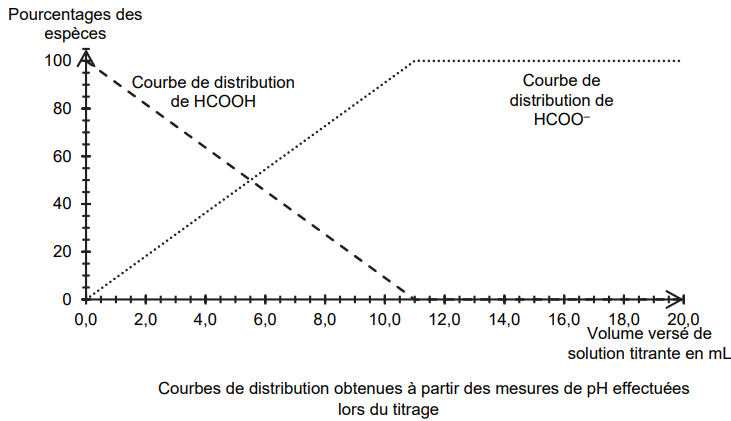
Q4. Écrire
l’équation de la réaction dont la constante thermodynamique d’équilibre
correspond à la constante
d’acidité Ka du couple acide méthanoïque / ion méthanoate.
HCOOH aq + H2O(l) = HCOO-aq + H3O+aq.
Q5. Estimer, en
expliquant la démarche, à l’aide des figures, la valeur de la constante
d’acidité Ka du
couple acide méthanoïque / ion méthanoate à la température du titrage.
pH = pKa =3,6 à la demi équivalence du titrage.
Ka = 10-3,6 ~2,5 10-4.
La valeur tabulée de la constante d’acidité associée à ce couple
est égale à 1,75×10-4 à 25 °C.
Q6. Identifier une
des causes expliquant l’écart entre la valeur tabulée et la valeur
calculée à la question Q5
de la constante d’acidité Ka du couple acide méthanoïque / ion
méthanoate.
Imprécision sur le volume équivalent.
Pour Véq = 11,4 mL on trouve pKa =3,8. ( Ka =2,5 10-4 ).
Hydroxyde de sodium carbonaté, imprésicion sur sa concentration.
On étudie une solution aqueuse d’acide méthanoïque
de concentration initiale en soluté apportée cA.
Q7. Montrer que le
quotient de réaction, noté Qr, associé à la réaction écrite à la
question Q4, s’écrit :
Qr = [H3O+]2 / ([CA-[H3O+] c°)
avec c° la concentration standard.
Qr =[H3O+][HCOO- ] / ([HCOOH] c°).
[H3O+]
=[HCOO- ].
CA = [HCOO- ]
+[HCOOH].
Par suite : Qr = [H3O+]2 / ([CA-[H3O+] c°)
Q8. Montrer que l’on peut
estimer la valeur de KA à une température donnée avec la
relation suivante :
KA= tf
2·cA / ((1-tf)c°)
avec tf
le taux d’avancement final.
[H3O+]f =tf ·cA
; CA-[H3O+]f
=CA(1-tf
).
KA=Qr f =(tf ·cA)2
/ (CA(1-tf )c°)=tf
2·cA / ((1-tf)c°).
Le taux d’avancement tf
vérifie une équation du 2nd degré de la forme :
A ·tf
2 + B · tf
+ C = 0 avec A, B et C des constantes.
Le calcul du taux d’avancement est effectué à l’aide d’un programme
écrit en langage Python dont un extrait
est donné :
4
# Demandes des valeurs utiles.
5. cA=float(input("Indiquer la concentration apportée cA
(en mol/L) de l’acide :"))
6.KA=float(input("Indiquer la valeur de la constante d’acidité KA :"))
7. c° = 1.0 # valeur de la concentration standard en mol/L
8
9 # Equation du 2nd degré vérifiée par le taux d’avancement
10.# équation du type : A ·tf ^2 + B · tf + C = 0
11. A = ? # expression de A
12. B= ? # expression de B
13. C = ? # expression de C
Q9. Compléter les
lignes 11, 12 et 13 permettant au programme d’être exécuté. Détailler
la démarche.
tf
2·cA =KA
((1-tf)c°).
tf
2·cA +KA
c°tf -KA
c° =0.
A = cA ; B = KA c° ;C = -KA c°.
Pour une solution aqueuse d’acide méthanoïque de concentration
apportée égale à 8,8×10−2 mol·L–1, le
résultat obtenu par le programme est donné ci-dessous :
Indiquer la concentration apportée cA (en mol/L) de l’acide :0.088.
Indiquer la valeur de la constante d’acidité KA :1.75e-4
Il y a 2 solutions possibles pour le taux d’avancement final :
tau1 = -0.046
tau2 = 0.044
Q10. À partir des
résultats ci-dessus du programme, déterminer en justifiant si l’acide
méthanoïque peut être
considéré comme un acide fort ou un acide faible dans l’eau dans les
conditions de l’expérience.
On retient la valeur positive 0,044.
Cette valeur étant très inférieure à 1, l'acide méthanoïque réagit
partiellement avec l'eau ; c'est un acide faible.
|
...
|
....
|
2. Synthèse du méthanoate d’éthyle à partir d’acide méthanoïque.
Le méthanoate d’éthyle peut être utilisé, par exemple, comme solvant organique, mais également pour donner
une odeur de rhum à un aliment.
La synthèse du méthanoate d’éthyle se fait à partir d’acide méthanoïque et d’éthanol. L’équation de la réaction
modélisant cette transformation chimique peut s’écrire :
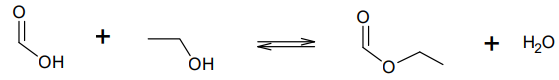
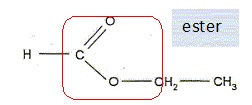
Q11. Écrire sur votre copie la formule semi-développée du méthanoate d’éthyle, entourer le groupe
caractéristique et nommer la famille fonctionnelle associée.
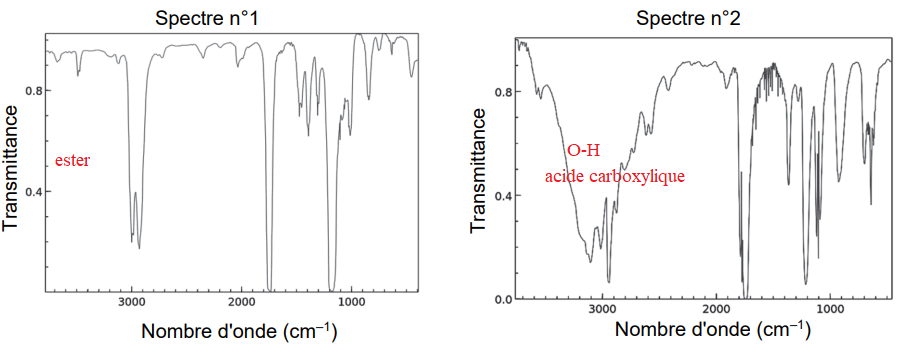
Q12. Les spectres IR de l’acide méthanoïque et du méthanoate d’éthyle sont donnés.Attribuer, en
justifiant, chaque spectre à l’espèce chimique correspondante.
On réalise la synthèse du méthanoate d’éthyle selon le protocole suivant :
- introduire dans un ballon 11,5 g d’éthanol, 11,5 g d’acide méthanoïque, 5 gouttes d’acide sulfurique
concentré et quelques grains de pierre ponce ;
- chauffer à reflux durant 45 min ;
- laisser refroidir.
Q13. Citer un intérêt à l’utilisation d’un montage à reflux.
On accélère la réaction, la température étant un facteur cinétique tout
en évitant les pertes de matière ( les vapeurs se condensent dans le
réfrigérant et retombent dans le milieu réactionnel ).
Pour déterminer le rendement de la synthèse, on réalise un titrage de l’acide méthanoïque restant dans le
milieu réactionnel à la fin de la synthèse. On en déduit que la valeur de la quantité de matière d’acide
méthanoïque restante est égale à 0,13 mol.
Q14. Calculer le rendement de cette synthèse.
Quantités de matière initiales :
acide : m / M(acide) = 11,5 / 46=0,25 mol.
alcool : 11,5 / 46,1 ~0,25 mol.
On peut espérer obtenir au mieux 0,25 mol d'ester.
Rendement = valeur expérimentale / valeur théorique = 0,13 / 0,25 =0,52.
Pour optimiser le rendement de la synthèse, on modifie certaines conditions expérimentales. Les différentes
modifications sont présentées :
1
À l’aide d’un montage à reflux, on fait réagir durant 45 minutes 0,50 mol d’éthanol,
0,25 mol d’acide méthanoïque, 5 gouttes d’acide sulfurique concentré et quelques
grains de pierre ponce.
Rendement 67 %
.
2
À l’aide d’un montage à reflux, on fait réagir durant 45 minutes 1,0 mol d’éthanol,
0,25 mol d’acide méthanoïque, 5 gouttes d’acide sulfurique concentré et quelques
grains de pierre ponce.
Rendement 76 %
3
À l’aide d’un montage de distillation fractionnée, on fait réagir durant 45 minutes
0,50 mol d’éthanol, 0,25 mol d’acide méthanoïque, 5 gouttes d’acide sulfurique
concentré et quelques grains de pierre ponce.
Rendement 93 %.
Lors de la synthèse utilisant la voie n°3, le thermomètre au sommet de la colonne de distillation (colonne de
Vigreux) indique une température de 54 °C.
( température d'ébullition de l'ester).
Q15. Identifier les conditions expérimentales mises en œuvre dans les
protocoles qui permettent d’optimiser le rendement de la synthèse.
L'un des réactifs doit être en excès.
Eliminer du milieu réactionnel le produit le plus volatil au fur et à mesure qu'il se forme.
|
|