On étudie la composition d'un
vinaigre ménager puis sa transformation chimique avec de
l'hydrogénocarbonate de sodium.
1. Propriétés acido-basique de l'acide éthanoïque.
Le vinaigre ménager est une solution aqueuse d'acide éthanoïque de formule CH
3COOH.
Q1.
Représenter le schéma de Lewis de la base conjuguée de l'acide éthanoïque.
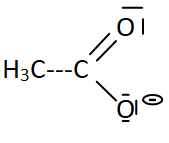 Q2.
Q2. Indiquer l'espèce majoritaire du couple de l'acide éthanoïque présente dans un vinaigre ménager ( pH = 2,2).
pKa ( acide éthanoïque / ion éthanoate) = 4,76.
A pH inférieur à pKa, la forme acide CH
3COOH prédomine.
Le pH d'une solution aqueuse d'acide éthanoïque de concentration 5,0 10
-3 mol / L est 3,5.
Q3.
Ecrire l'équation de la réaction modélisant la transformation entre l'acide éthanoïque et l'eau.
CH
3COOH aq + H
2O(l) = CH
3COO
-aq + H
3O
+aq.
Q4. Montrer que le taux d'avancement final de cette réaction est de l'ordre de 6 %. Commenter.
[CH3COO-aq] = [H3O+aq] = 10-pH =10-3,5 ~3,2 10-4 mol / L.
3,2 10-4 / (5,0 10-3) ~0,06 ( 6 %).
La réaction de l'acide éthanoïque avec l'eau est partielle. L'acide éthanoïque est un acide faible.
2. Dosage par titrage du vinaigre ménager 14 °.
Le degré d'acidité d'un vinaigre ménager est égal au titre massique, exprimé en pourcentage, en acide éthanoïque de ce vinaigre.
On réalise le titrage d'un volume V= 10,0 mL de ce vinaigre dilué 100
fois par une solution d'hydroxyde de sodium de concentration C
B=2,00 10
-2 mol / L.
Q 5. Ecrire l'équation de la réaction support du titrage.
CH
3COOH aq + HO
-aq --> CH
3COO
-aq + H
2O(l).
Q 6. Déterminer le volume équivalent.
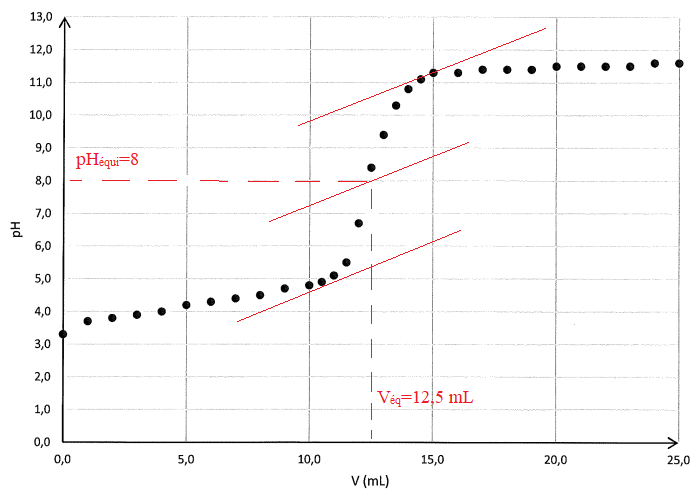 Q.7.
Q.7. Expliquer quel aurait été l'indicateur coloré le plus adapté pour réaliser ce titrage par colorimétrie.
La zone de virage de l'indicateur doit contenir le pH du point équivalent.
Zone de virage du rouge de crésol [7,8 ; 8,8 ].
Q.8. Déterminer la concentration de la solution diluée 10 fois et calculer le titre massique du vinaigre.
A l'équivalence, C
A V = C
B V
éq ; C
A =2,00 10
-2 x 12,5 / 10 = 0,025 mol / L.
Tenir compte de la dilution : 2,5 mol / L soit 2,5 x M(acide éthanoïque) =2,5 x 60 = 150 g d'acide dans 1000 g de solution.
150 / 1000 = 0,15 ( 15 °).
Ecart relatif ( 15-14 ) / 14 = 0,07 ( 7 %).
L'indication 14 ° est correcte.
3. Etude cinétique de la transformation chimique entre le vinaigre et l'hydrogénocarbonate de sodium.
CH
3COOH (aq) + NaHCO
3 (s) --> Na
+aq + CH
3COO
-aq +CO
2(g) + H
2O(l), réaction lente.
A partir de 1 g d'hydrogénocarbonate de sodium solide, versé à la
date t=0, dans une centaine de millitres de vinaigre ménager 14° en
excès, on ralise l'expérience suivante :
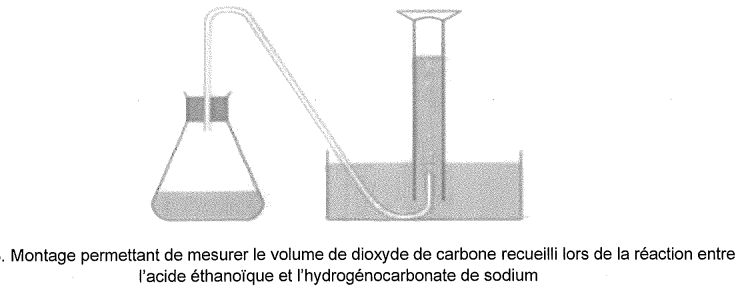
Les résultats sont consignés sur le graphe suivant.
Q 9. Déterminer lla quantité de matière de CO
2 formé à 30 s.
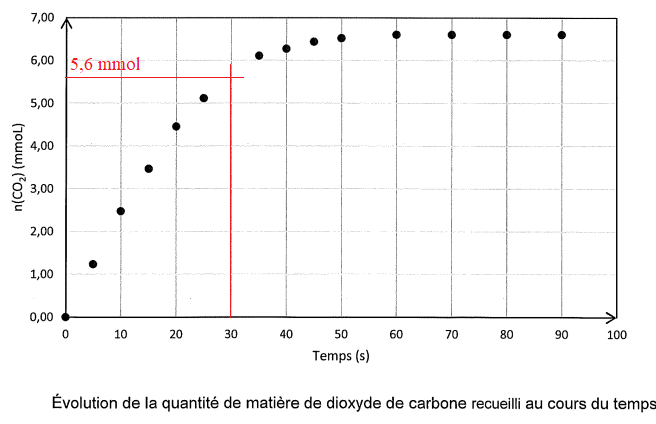 Q 10
Q 10. Déterminer le temps de demi-raction et commenter.
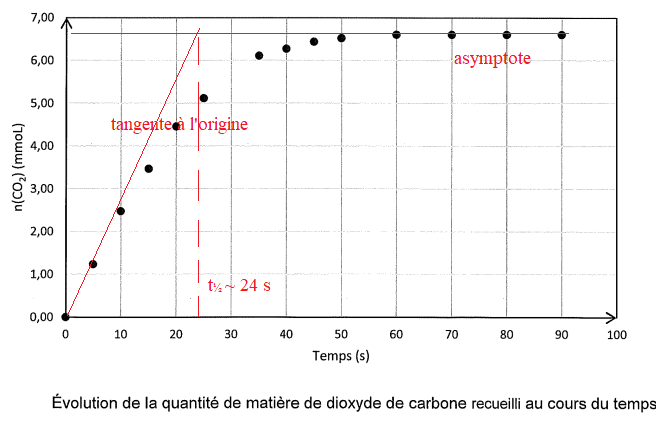
Cette transformation chimique est lente.