La vanilline est le constituant principal de l'essence de vanille. Elle est extraite de gousses de vanille
séchées et fermentées.
On se propose dans cet exercice de déterminer la masse de vanilline présente dans un arôme
alimentaire de vanille Bourbon. Pour cela, on commence par préparer une solution de référence
dont on détermine la concentration en vanilline par titrage suivi par conductimétrie. Cette solution
de référence est ensuite utilisée pour réaliser un dosage par étalonnage utilisant la
spectrophotométrie.
Préparation d’une solution de référence.
On réalise la dissolution d’une faible quantité de vanilline commerciale, dans une solution aqueuse
basique d’hydroxyde de sodium. On obtient une solution, notée S
1. Dans cette solution S
1, la
vanilline, notée VH, a réagi avec les ions hydroxyde pour former l’ion vanillinate, noté V
–
. L’équation
de la réaction modélisant cette transformation chimique est la suivante :
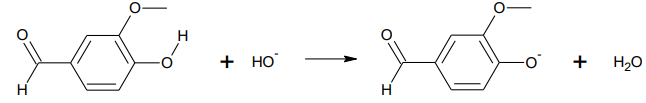 1.1.
1.1. Écrire la formule brute de la vanilline.
C
8H
8O
3.
1.2. Identifier les deux couples acide/base mis en jeu lors de cette réaction.
VH /V
- et H
2O /HO
-.
2. Titrage de la solution de référence S
On réalise le titrage d’un volume V
1 = 20,0 mL de solution S
1, auquel on ajoute environ 150 mL d’eau
distillée, par de l’acide chlorhydrique de concentration C
a = 1,0×10
–1 mol·L
–1
. Le titrage est suivi par
conductimétrie.
On obtient la courbe de suivi du titrage suivante :
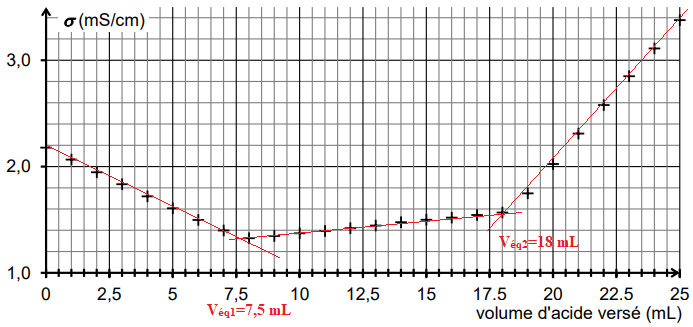
Cette courbe fait apparaitre trois phases distinctes :
première phase : titrage de l’excès des ions hydroxyde ;
deuxième phase : titrage de la base conjuguée de la vanilline ;
troisième phase : ajout d’acide en excès dans le milieu
2.1. Écrire l’équation de la réaction support du titrage qui a lieu lors de la première phase.
HO
-aq +H
3O
+aq --> 2H
2O(l).
2.2. Déterminer graphiquement le volume d’acide nécessaire au titrage des ions hydroxyde.
2.3. Justifier la pente de la courbe lors de cette première phase.
Les ions hydroxyde disparaissent ; les ions oxonium sont en défaut ; on ajoute des ions chlorure.
Du point de vue de la conductivité, tout se passe comme si on
remplaçait des ions hydroxyde par des ions chlorure de conductivité
molaire ionique moindre.
L’équation de la réaction support du deuxième titrage peut s’écrire :
V
–
(aq) + H
3O
+
(aq) → VH(aq) + H
2O(ℓ).
2.4. D’après l’allure de la courbe dans cette deuxième phase du titrage, indiquer si la conductivité
ionique molaire de l’ion vanillinate (V
–
) est inférieure, supérieure ou égale à celle des ions
chlorure. Justifier.
La conductivité de la solution augmente. L'ion oxonium est en défaut.
Du point de vue
de la conductivité, tout se passe comme si on remplaçait des ions
valinilate par des ions chlorure de conductivité molaire ionique plus
grande.
2.5. Déterminer le volume d’acide nécessaire au seul titrage de l’ion vanillinate, en explicitant votre
démarche.
V
éq2 -V
éq1 = 18 - 7,5 = 10,5 mL.
2.6. En déduire la valeur de la concentration C
V- en ions vanillinate dans la solution S
1.
Ca (
Véq2 -Véq1)= C
V-V
1.
CV-=0,10 x 10,5 / 20,0 =0,525 ~ 5,3 10-2 mol / L
3. Dosage de la vanilline dans l’arôme alimentaire de vanille Bourbon.
Protocole utilisé
- Placer 1,0 mL d’arôme alimentaire de vanille Bourbon dans une ampoule à décanter avec
un peu d’eau.
- Extraire la vanilline présente dans la phase aqueuse à l’aide d’éthanoate d’éthyle et
conserver la phase organique obtenue dans l’ampoule à décanter.
- Extraire la vanilline présente dans la phase organique précédente avec une solution aqueuse
d’hydroxyde de sodium.
- Transvaser la phase aqueuse obtenue dans une fiole jaugée de 250,0 mL et compléter au
trait de jauge avec la solution d’hydroxyde de sodium.
On appelle S
2 cette solution.
On réalise alors les spectres d’absorption UV-visible :
de la solution S
2 obtenue à l’aide du protocole ci-dessus ;
d’une solution S
3 obtenue en diluant 1000 fois la solution de référence S
1 étudiée dans la
deuxième partie.
La concentration en vanilline dans la solution S
3 est C
val = 5,3×10
-5 mol·L
–1
.
On obtient les spectres ci-dessous.
3.1. Les solutions S
2 et S
3 sont-elles colorées ? Justifier.
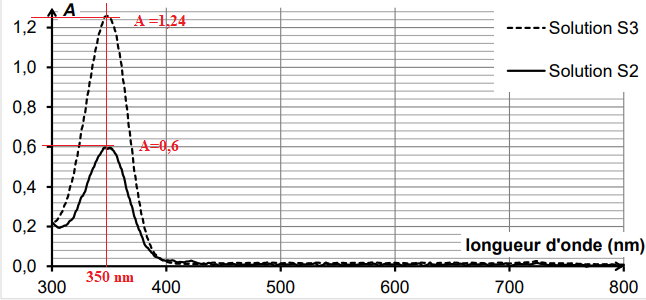
Le maximum d'absorption se situe vers 350 nm, domaine UV. Les solutions ne sont pas colorées.
3.2. Estimer la masse de vanilline présente dans 1 litre d’arôme alimentaire, en supposant la loi de
Beer-Lambert vérifiée par les solutions dans les conditions de l’expérience.
S
2 : A = 0,6 ; S
3 : A = 1,24 ;
Rapport des absorbance = rapport des concentrations =1,24 / 0,6 ~2,1.
C
val /
C2 = 2,1 ; C2 =5,3 10-5 /2,1 =2,5 10-5 mol/ L.
Soit 5,25 10-6 mol dans 250 mL ou dans 1 mL d'arôme alimentaire.
5,25 10-3 mol dans 1 mL d'arôme alimentaire.
M(vaniline) = 152 g / mol.
m =5,25 10-3 x152 =0,80 g.