Acide
benzoïque, benzoate de sodium,
Bac Nlle Calédonie 2022.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
A. Réaction de l'acide benzoïque avec l'eau.
On introduit une masse m 0 d'acide benzoïque dans l'eau distillée afin d"obtenir un volume V 0 = 100 mL de solution notée S 0 de concentration C 0 = 1,0 10 -2 mol / L. Le pHmètre indique 3,1.
A1. Calculer m 0. La solution est'elle saturée ?
M(C 6H 5COOH) = 122 g / mol.
n = C 0V 0 = 1,0 10 -2 x 0,10 = 1,0 10 -3 mol.
m 0 = n M(C6H5COOH) =1,0 10-3x 122 = 0,122 ~0,12 g.
La solubilité de l'acide benzoïque à 25°C étant égale à 2,4 g / L ( 0,24 g dans 100 mL), la solution n'est pas saturée.
A2. Ecrire l'équation de la réaction de l'acide benzoïque avec l'eau.
C6H5COOH aq + H2O(l) = C6H5COO- aq + H3O+ aq .
A3. Tracer le diagramme de
prédominance du couple acide benzoïque / ion benzoate. pKa = 4,2.
Quelle espèce prédomine dans la solution S 0 ?
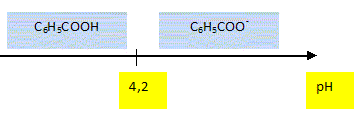
A pH inférieur à pKa, la forme C6H5COOH prédomine.
A4. Compléter le tableau d'avancement.
Etat
|
Avancement (mol)
|
C6H5COOH aq |
+ H2O(l) |
= C6H5COO- aq |
+ H3O+ aq . |
initial
|
0
|
C0V0 = 1,0 10-3
|
Solvant
|
0
|
0
|
final
|
xéq =10-pHx V0~7,9 10-5
|
C0V0 -xéq |
xéq |
xéq |
A.5. Calculer l'avancement maximal.
x max = 1,0 10-3 mol.
A.6. Montrer que la taux d'avancement final s'écrit t = [ H3O+ aq] / C 0 puis le calculer.
t =xéq / xmax= xéq /V0 / (xmax/V0)= [H3O+ aq] / C0 =10-3,1 / 10-2 =0,079.
Ce résultat est en accord avec la question A 3 : la réaction de l'acide benzoïque avec l'eau est partielle ; la forme C6H5COOH aq prédomine à pH < 4,2.
|
...
|
....
|
B. Synthèse de l'acide benzoïque.
Dans un ballon bicol versé V1 = 2,0 mL d'alcool benzylique C6H5CH2OH, 20 mL de soude, quelques grains de pierre ponce. On réalise un montage à reflux.
Etape 1.
Verser lentement une solution aqueuse de permanganate de potassium dans
le ballon. Porter le mélange à ébullition douce pendant 10 minutes.
Ajouter quelqsue millilitres d'éthanol afin d'éliminer le permanganate de potassium en excès, puis on refroidit le ballon.
Etape 2.
On filtre le mélange obtenu : le filtrat est limpide et incolore. Ikl
est refroidit dans la glace. On ajoute lentement 8,0 mL d'acide
chlorhydrique concentré ; on observe la formation d'un précipité blanc
d'acide benzoïque. On filtre et on rince avec un peu d'au froide.
On obtient après séchage m' = 1,4 g de solide.
B1.1. Sur quells facteurs cinétique se base t-on pour réaliser rapidement cette synthèse ?
La température est un facteur cinétique.
La concentration de l'un des réactifs ( permanganate en excès ) est un autre facteur cinétique.
B1.2. Quels sont les avantages du chauffage à reflux ?
En travaillant à température modérée on accélère la réaction tout en
évitant les pertes de matière : les vapeurs se condensent dans le
réfrigérant et tombent dans le milieu réactionnel.
On donne l'équation de la réaction en milieu basique :
3 C6H5CH2OH (l) + 4 MnO4-aq -->3 C6H5COO-aq + 4H2O(l) +4MnO2(s) + HO-aq.
B.2.1. Déterminer la quantité de
matière n1 d'alcool benzylique contenu dan 2,0 mL.
Masse volumique de cet alcool : 1,0 g /mL ; masse molaire 108 g / mol.
n1 = 2,0 / 108 ~1,851 10-2 ~1,9 10-2 mol.
B.2.2.
Lors de la cristallisation le passage de l'ion benzoate à l'acide
benzoïque est totale. Calculer la quantité de matière d'acide benzoïque
que l'on peut obtenir ( l'alcool benzilique étant le réactif limitant).
1,9 10-2 mol.
B2.3. En déduire le rendement de la synthèse.
Masse théorique d'acide benzoïque : 1,851 10-2 x 122 ~2,26 g.
Rendement = masse réelle / masse théorique = 1,4 / 2,26 ~0,62 ( 62 %).
|
|