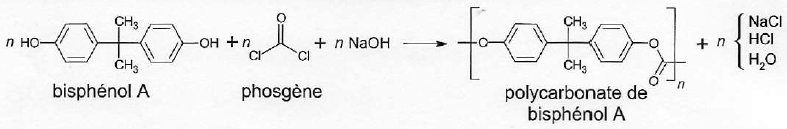
Il s'agit d'un polymère. L'équation de la raction modélisant la polymérisation est donnée :
A Etude des réactifs.
A1. Identifier les groupes caractéristiques présents dans le bisphénol et le phosgène.
Groupe hydroxyle O-H et carbonyle C=O.
A2. Le phosgène est produit à partir du dichlore gazeux et du monoxyde de carbone dans un réacteur à 250 °C.
CO(g) + Cl
2(g) --> COCl
2(g).
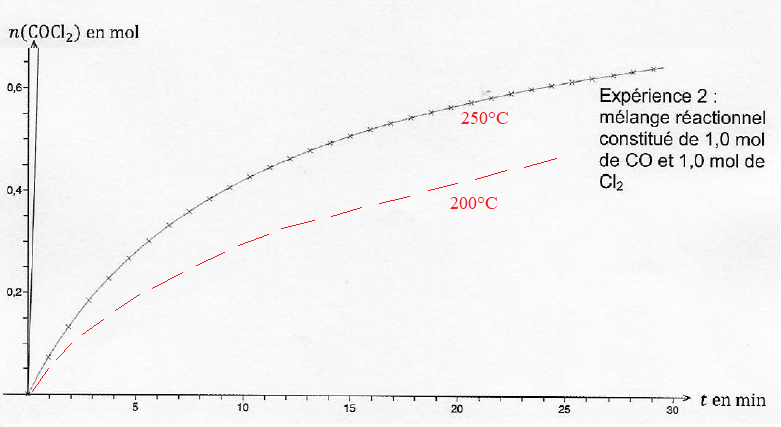
On réalise deux expériences au cours desquelles on mesure la quantité
de matière de phosgène formé au cours du temps dans une enceinte de
volume V = 30 L à T = 250°C.
 A2.1.
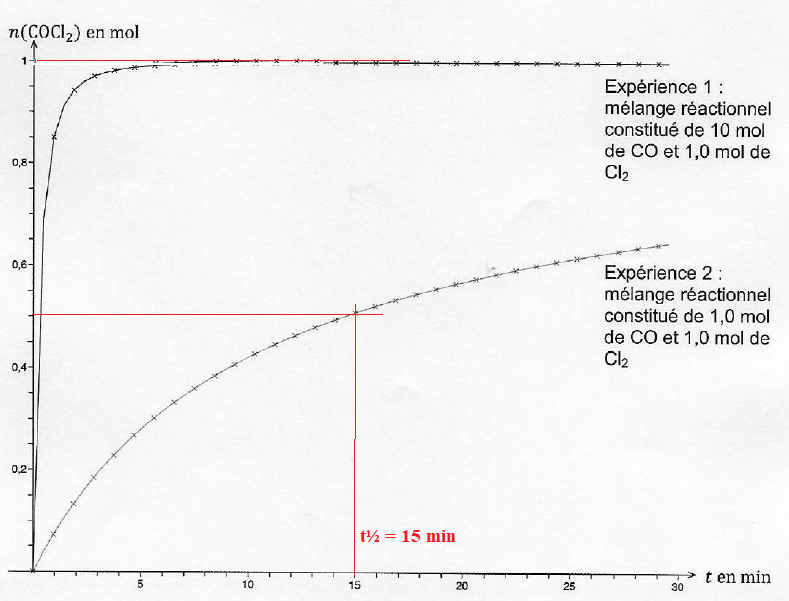
A2.1. Déterminer la valeur de l'avancement final dans l'expérience 1.
L'avancement final est égal à 1,0 mol.
A2.2. Justifier que la synthèse du phosgène est une transformation totale, puis en déduire l'avancement final dans l'expérience 2.
Expérience 1 : l'avancement final est égal à la quantité de matière du
réactif limitant, le dichlore. La transformation est donc totale.
Expérience 2 : les proportions sont stoechiométriques ; quantité de matière de phosgène = 1,0 mol
A.2.3. Donner la définition du temps de demi-réaction.
Le temps de demi-réaction est la durée au bout de laquelle l'avancement est égal à la moitié de l'avancement final.
A.2.4. Déterminer le temps de demi-réaction pour l'expérience 2.
t½ = 15 min.
A.2.5 Comparer le temps de demi-réaction de l'expérience 1 à celui de l'expérience 2 et justifier leur écart.
Expérience 1 : t½ < 1 minute, l'un des réactifs étant en large excès.
A.2.6. Calculer les vitesse volumiques de formation du phosgène à t = 20 min et commenter.
v = d[COCl
2] / dt.( pente de la tangente à la courbe à la date considérée).
Expérience 1 : v = 0 ( tangente horizontale), la réaction est terminée.
Expérience 2 : v = 0,2 / 25 ~0,008 mol min
-1, la réaction n'est pas terminée.
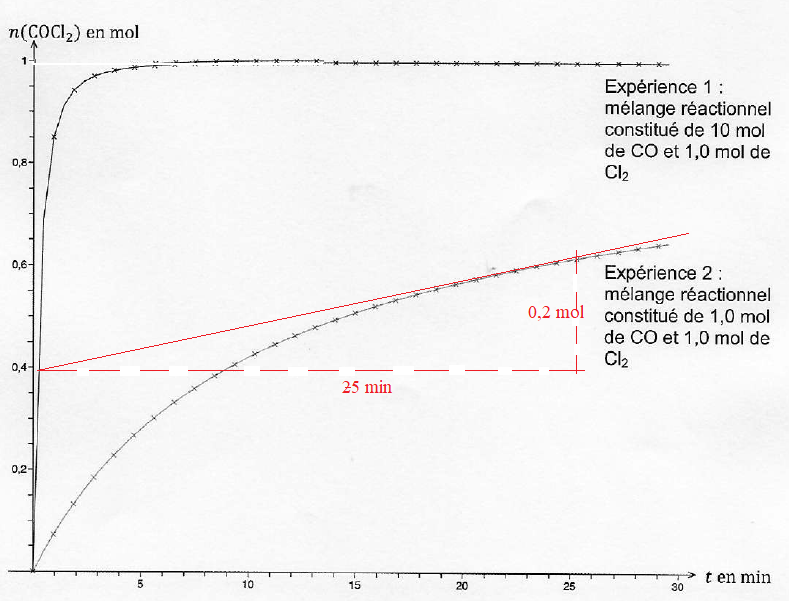 A.2.7
A.2.7. Un mélange réactionnel de 1,0 mol de CO et de 1,0 mol de Cl
2
est introduit dans le réacteur à T = 200 °C. Justifier l'allure de la
courbe donnant l'évolution de la quantité de matière de phosgène en
fonction du temps.
La température est un facteur cinétique ; à 200°C le temps de
demi-réaction est inférieur à 15 min ( expérience réalisée à 250°C).
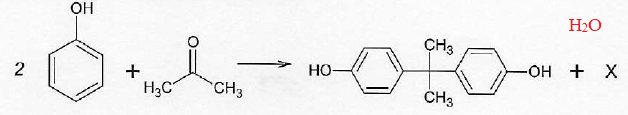
 Le bisphénol est synthétisé à partir d'acétone et de phénol.
A.3.1
Le bisphénol est synthétisé à partir d'acétone et de phénol.
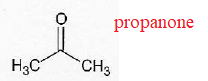
A.3.1 Donner le nom de l'acétone en nomenclature systématique.
 A.3.2.
A.3.2. Identifier l'espèce chimique X.
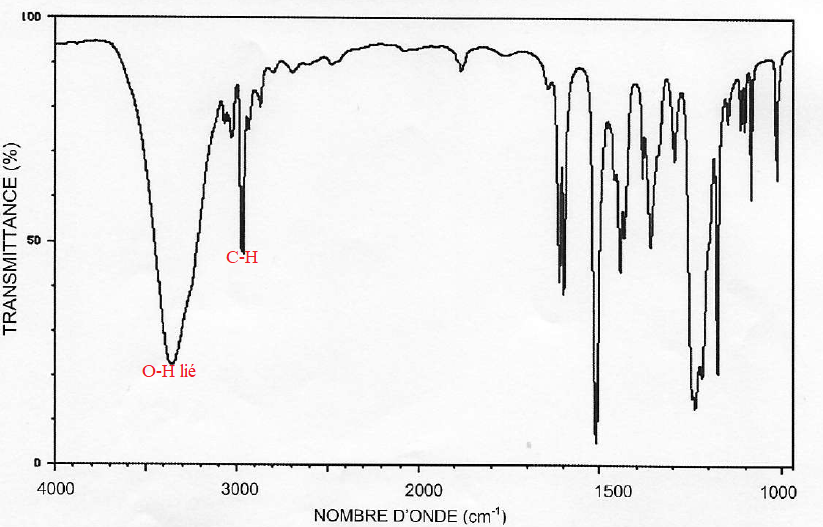
 A.3.3.
A.3.3. On donne le spectre du bisphénol. Identifier les liaisons responsables des bandes d'absorption à 3300 cm
-1 et 2950 cm
-1.