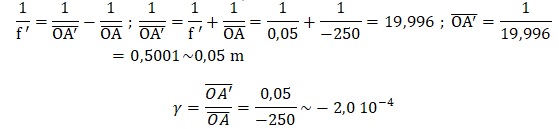Physique
chimie, chauffage et eau chaude de la maison ;
comparaison de deux appareils à fondue ; photographie argentique
noir et blanc.
E3C : enseignement de spécialité première générale.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
|
.
.
|
......
.....
|
1.
Chauffage de la maison.
La maison est équipée d'un chauffage central à partir d'une chaudière
fonctionnant au gaz naturel. Afin de réaliser des économies d'énergie,
le choix a été fait d'installer une chaudière à condensation. Le
principe de fonctionnement d'une chaudière à condensation est illustré
sur cidessous.
Dans le brûleur (1), la combustion du gaz naturel permet de transférer
de l'énergie à l'eau du circuit de chauffage (2). Cette eau, après
avoir alimenté les radiateurs (3), circule dans un serpentin (4) mis en
contact avec les produits de la combustion du gaz naturel (5). Ces
produits se condensent au contact de l'eau froide et les condensats
produits dans la chaudière (6) sont
ensuite rejetés à l'égout. La condensation étant un phénomène
exothermique, de l'énergie thermique est ainsi fournie à l'eau du
circuit de chauffage.
1.1. Écrire
l'équation de la réaction modélisant la combustion du gaz naturel dans
le dioxygène.
La formule du méthane est CH4 et les produits de combustion
sont le dioxyde de carbone et l’eau.
CH4 + 2O2 ---> CO2 + 2H2O.
1.2. Établir le
schéma de Lewis des molécules de dioxyde de carbone et d’eau.

1.3. À partir du
tableau donnant les valeurs des énergies de liaison, calculer celle de
l’énergie m olaire de réaction de la combustion du gaz naturel dans le
dioxygène et justifier du caractère exothermique de la transformation.
En déduire que le pouvoir calorifique du méthane est d’environ 50 kJ·g-1.
Liaisons rompues : 4 liaisons C-H (411 kJ / mol) et 2 liaisons O=O (
494 kJ / mol).
Liaisons créées : 2 liaisons C=O ( 795 kJ / mol) et 4 liaisons
H-O (459 kJ / mol).
4 x 411 + 2 x494 -(2 x795 +4 x459) =2632 - 3426 = -794 kJ / mol.
Cette valeur étant négative, la réaction est exothermique.
794 kJ pour 16 g de méthane soit ~50 kJ / g.
1.4. Calculer
l’énergie thermique libérée au cours de la combustion de 100 g de
méthane.
Montrer qu’au cours de cette combustion il se forme 225 g de vapeur
d’eau.
50 x100 = 5,0 103 kJ.
Quantité de matière de méthane : 100 / M(méthane) = 100 / 16 = 6,25 mol.
Quantité de matière d'eau : 2x 6,25 = 12,5 mol.
Masse d'eau : 12,5 x M(eau) =12,5 x18 = 225 g.
1.5. On fait
l'hypothèse que toute la vapeur d'eau formée lors de la combustion se
condense et que seule l'énergie libérée lors de la condensation de
l'eau est récupérée. Calculer la valeur de l’énergie associée à la
condensation de la vapeur d’eau formée pour 100 g de méthane puis
montrer que l’utilisation de cette énergie permet de réaliser un gain
maximal d’environ 10 % en énergie.
La valeur de l'énergie libérée par la condensation d'un gramme d'eau
est : 2,3 kJ ;
2,3 x 225 ~517 kJ.
517 / (5,0 103) ~0,10 (~10 %).
2. Eau chaude sanitaire.
Dans ce logement l'eau chaude sanitaire est fournie par chauffe-eau qui
fonctionne à l'électricité. Le principe est simple : une résistance
électrique placée dans le cumulus chauffe l'eau jusqu'à une température
définie appelée température de consigne.
2.1. Nommer le
phénomène physique qui permet le chauffage de l'eau dans le cumulus.
Déterminer la valeur de la résistance chauffante du cumulus. Tension de
fonctionnement U = 230 V ; puissance P = 1800 W.
L'énergie électrique est convertie en énergie thermique : effet Joule.
P = U I acec U = RI ; P = U2 / R ; R = U2 /
P = 2302 / 1800=29,4 ohms.
2.2. Calculer la
valeur de l’énergie thermique nécessaire à l’élévation de la
température de la totalité de l’eau du cumulus.
Capacité : 150 L ; temps de chauffe 5 h 15 ;température initiale de
l'eau 15°C ; température finale : 65°C ; capacité thermique massique de
l'eau c = 4,18 103 J kg-1 °C-1.
Q = m c DT = 150
x4,18 103 x(65-15) =3,135 107 ~3,1 107
J.
2.3. Utiliser la
puissance du chauffe-eau pour en déduire la durée nécessaire à cette
élévation de température. Comparer à la valeur indiquée par le
constructeur et proposer une explication à une éventuelle différence.
t = Q / P =3,135 107 / 1800 =1,74 104 s ( 4 h 50
min ).
L'eau n'est pas initialement à 15 °C, mais à une température plus
faible.
Mauvaise isolation thermique du chauffe-eau.
Le cumulus est installé au rez-dechaussée d’une maison de deux étages.
Le graphe ci-dessous indique la pression minimale de l’eau en sortie du
cumulus en fonction de l’altitude z du Pour un fonctionnement correct
l’eau doit arriver au point de distribution avec une pression minimale
de 2,50 bar.
2.4. Commenter
l’allure du graphe puis l’utiliser pour estimer la pression minimale de
l’eau en sortie du cumulus nécessaire à la distribution d’eau chaude
dans une maison de deux étages ( environ 5 m plus haut ).

La différence de pression entre les étages et le rez-de chaussée est
proportionnelle à l'altitude z. La pression en sortie du chauffe-eau
doit être d'environ 3 bar.
|
...
|
|
|
....
|
Comparaison de deux appareils à fondue
(10 points)
Des élèves souhaitent comparer deux appareils à fondue, l’un
traditionnel utilisant comme source de chaleur un petit réchaud à
alcool et l’autre fonctionnant à l’électricité.
Partie 1. Étude de
l’appareil à fondue utilisant le réchaud à alcool.
L’eau contenue dans le récipient,appelé caquelon, est chauffée à
l’aide du réchaud dans lequel de l’éthanol a été enflammé à l’aide
d’une allumette. Un thermomètre immergé dans l’eau permet de suivre
l’évolution de la température de l’eau au cours du temps. À l’issue de
l’expérience l’alcool a été entièrement brûlé.Grandeurs mesurées :
- masse du réchaud vide : mréchaud vide = 73,61 g ;
- masse du réchaud avec l’éthanol : mréchaud rempli = 78,96
g ;
- masse du récipient vide : Mrécipient vide = 1,735 kg ;
- masse du récipient rempli avec de l’eau : Mrécipient rempli
= 2,049 kg.
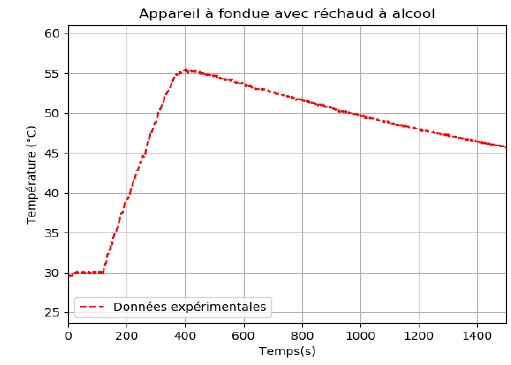
Courbe représentant l’évolution de la température de l’eau au cours du
temps
Réaction de combustion.
Une réaction de combustion totale modélise une transformation chimique
faisant intervenir un combustible (alcane ou alcool) et un comburant
(dioxygène) et produisant du dioxyde de carbone et de la vapeur d’eau.
Formule brute de l’éthanol : C2H5OH
1. À l’aide des
données expérimentales, calculer la valeur de l’énergie thermique Eeau
reçue par l’eau lors de la combustion de l’éthanol.
Masse d'eau m = 2,049 -1,735=314 g (0,314 kg ).
ceau = 4,18 kJ kg-1 °C-1.
Différence de température de l'eau : 56-30 = 26°C.
Eeau =m ceau DT =0,314 x4,180 x26 ~34,1 kJ.
2. Écrire
l’équation de la réaction de combustion de l’éthanol. On rappelle que
les produits formés lors de cette transformation chimique sont l’eau et
le dioxyde de carbone.
2C2H5OH + 7O2 ---> 4 CO2
+ 6H2O.
3. Déterminer la
valeur de la quantité de matière néthanol d’éthanol utilisée
dans l’expérience.
Masse éthanol : 78,96 -73,61=5,35 g
néthanol = 5,35 / M(éthanol) = 5,35 / 46 =0,1163 ~0,12 mol.
4. On admet que la
valeur de l’énergie molaire de la réaction de combustion de l’éthanol
est Ecombustion = - 1,02.103 kJ.mol-1. En déduire
que la valeur de l’énergie thermique produite lors de la combustion de
la totalité de l’éthanol est de 1,18.102 kJ.
1,02 103 x0,1163 ~118 kJ.
5. Reproduire et
compléter le diagramme énergétique suivant en indiquant les transferts
d’énergie :

6. Définir le rendement énergétique
de cet appareil à fondue.
Rendement = énergie utile à chauffer l'eau / énergie fournie par la
combustion.
7. Montrer que ce
rendement énergétique est proche de 30 %.
34,1 / 118 ~0,29 ( 29 %).
Partie 2.
Étude de l’appareil à fondue fonctionnant à l’électricité.
Caractéristiques de l’appareil à fondue :
- tension 230 V ~ 50 Hz / 60Hz ; - puissance électrique consommée 900 W.
On chauffe 0,50 kg d’eau à l’aide d’un appareil à fondue électrique.
Pour élever la température de l’eau de 40 °C , il faut 1 min 55 s.
8. Montrer que le
rendement énergétique de l’appareil à fondue électrique est d’environ
80 %.
Energie reçue par l'eau : Q = m ceau DT = 0,50 x 4,18 x 40 = 83,6
kJ en 60+55 = 115 s.
Puissance correspondante : 83,6 / 115 ~0,73 kW.
Rendement : 0,73 / 0,90 ~0,81.
9. Proposer une
hypothèse permettant d’expliquer les différences de rendement
énergétique entre les deux appareils.
Meilleur isolation thermique du récipient de l'appareil électrique.
|
PARTIE B. Photographie
argentique noir et blanc (10 points)
La statue de la Liberté est l'un des
monuments les plus célèbres des États-Unis. Cette statue est située à New York sur l'île
Liberty Island. Le
monument, mesurant 93,0 mètres du sol jusqu’à la pointe de la torche,
fut construit en France et offert par le peuple français, en signe d'amitié entre les deux
nations, pour célébrer le
centenaire de la Déclaration d'indépendance américaine.
Partie 1 : distance de prise de vue et taille de l’image.
L’appareil photographique qui a réalisé le cliché ci-dessus est
constitué d’une pellicule photosensible dont la zone exposée à la
lumière a pour dimensions (24,0 mm × 36,0 mm) et
d’un objectif équivalent à une lentille convergente de distance focale
image f’ = 5,00 cm. Le photographe se situe à 250 m de la statue de la
Liberté. On peut modéliser la prise de vue à
l’aide du schéma de situation ci-dessous. On précise que ce schéma n’est pas à l’échelle.
1.1 Identifier sur ce schéma, le foyer image F’, le foyer objet F et le centre optique O.
1.2 Compléter ce
schéma en construisant l’image A’B’ de la statue de la Liberté
modélisée par AB, à l’aide d’au minimum deux rayons lumineux
particuliers.
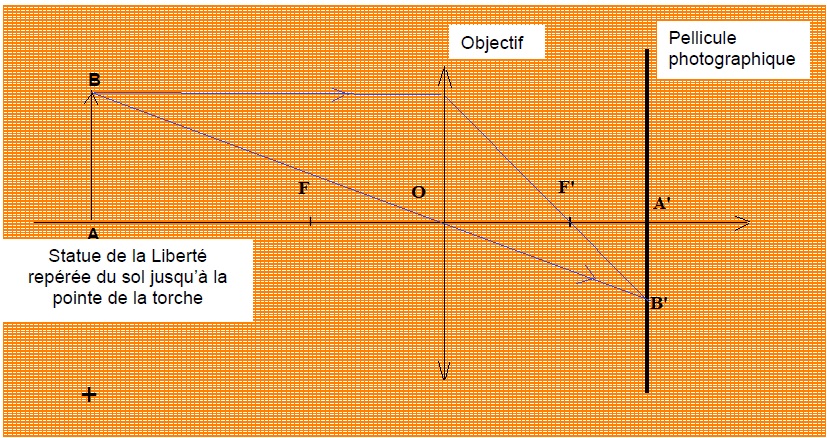
1.3 Citer deux adjectifs appropriés qui qualifient l’image.
L'image est réelle, inversée par rapport à l'objet.
1.4 Montrer, qu’en réalité, l’image de la statue de la Liberté se forme au voisinage immédiat du foyer image de la lentille.
1.5 Vérifier, par le calcul, que le grandissement vaut – 2,00×10−4.
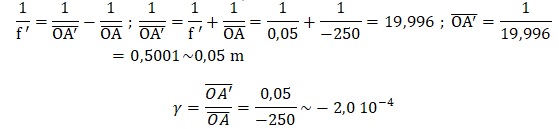
1.6 Expliquer si la statue de la Liberté peut apparaître en entier sur la pellicule.
2,0 10-4 x 93,0 =0,0186 m = 18,6 mm.
La pellicule photosensible dont la zone exposée à la
lumière a pour dimensions (24,0 mm × 36,0 mm).
La statue apparaît en entier sur la photo.
Partie 2 : révélation de la pellicule photosensible.
La pellicule photographique utilisée pour ce cliché contient quelques
milligrammes de microcristaux de bromure d'argent AgBr(s), constitués
d’ions Ag+ et Br−. Lors d'une prise de vue, sous
l’effet de la lumière, des ions bromure Br− cèdent des électrons à des ions argent Ag+, ce qui conduit la formation de quelques atomes d'argent Ag et contribuent à un noircissement localisé
de la pellicule constituant ainsi l’image latente. Cette dernière reste
invisible, même au microscope, car le nombre d’atomes d’argent formés
est trop faible.
La révélation consiste à multiplier de façon le nombre d'atomes
d'argent pour donner naissance au négatif en noir et blanc. L’un des
révélateurs les plus utilisés est une solution aqueuse
d’hydroquinone. Lors de la révélation, l’hydroquinone dissoute C6H6O2(aq) est transformé en benzoquinone C6H4O2(aq).
Ensuite, la pellicule ainsi traitée est plongée dans un bain d'arrêt
qui a pour but de stopper la révélation, puis dans un fixateur qui
stabilise l’image en la rendant insensible à la lumière par
l'élimination du bromure d'argent qui n'a pas réagi.
2.1 À l’aide d’un
raisonnement qualitatif faisant intervenir notamment les ions argent,
expliquer la raison pour laquelle les nuances de gris sont inversées
entre le négatif noir et
blanc et le paysage d’origine ?
Les zones exposées à la lumière apparaissent noires ( présence d'atomes
d'argent ) sur la pellicule. La révélation multiplie le nombre d'atomes
d'argent de ces zones.
Prenons le cas d'une scène simple : une lampe allumée dans une pièce noire

On modélise la révélation par une réaction chimique.
2.2 Écrire la demi-équation électronique qui traduit la transformation de l’hydroquinone en benzoquinone.
2.3 Préciser, en justifiant la réponse, s’il s’agit d’une oxydation ou bien d’une réduction de l’hydroquinone.
C6H6O2(aq) --> C6H4O2(aq)+ 2H+aq + 2e-. (1)
L'hydroquinone libère des électrons : c' est un réducteur qui s'oxyde.
2.4. Vérifier que l’équation de la réaction d’oxydoréduction modélisant la révélation s’écrit :
Les ions argent se réduisent : 2Ag+aq +2e- ---> 2Ag(s) (2)
Ajouter (1) et (2) : C6H6O2(aq) +2Ag+aq +2e---> C6H4O2(aq)+ 2H+aq + 2e- +2Ag(s).
Simplifier : C6H6O2(aq) +2Ag+aq --> C6H4O2(aq)+ 2H+aq +2Ag(s).
On s’intéresse à la révélation de la pellicule de dimensions 24,0 mm ×
36,0 mm qui a permis d’obtenir la photographie de la statue de la
liberté. On estime que la pellicule comporte
initialement 2,00 mg d’ions argent par cm2. Une fois la prise de vue réalisée, on fait tremper la pellicule dans un volume V = 50,0 mL de bain révélateur.
L’observation du négatif noir et blanc permet d’estimer que 40% de la
surface de la pellicule a noirci pendant la révélation. On considère
que les atomes d’argent qui constituent l’image
latente sont négligeables par rapport à la quantité d’ions argent contenus dans la pellicule.
2.5 Montrer que la quantité de matière d’ions argent n(Ag+) qui réagissent pendant la révélation pour obtenir le négatif vaut de l’ordre de 6×10-5 mol.
Surface de la péllicule : 2,4 x 3,6 =8,64 cm2.
Surface noircie après révélation : 8,64 x0,40 =3,456 cm2.
Masse initiale d'ion argent sur la partie noircie : 3,456 x 2,00=6,912 mg= 6,912 10-3 g.
Quantité de matière d'ion argent : 6,912 10-3 / M(argent) = 6,912 10-3 / 107,9 ~6 10-5 mol
2.6 Quelle doit être la concentration minimale C en hydroquinone dans le révélateur pour atteindre cet objectif ?
Quantité de matière d'hydroquinone : 3 10-5 mol dans 50 mL ou 0,050 L.
C = 3 10-5 / 0,05 =6 10-4 mol / L.
|
|
|