Physique
chimie, choix d'un moyen de transport, des esters qui flattent nos
cellules olfactives,
teneur en fer d'un produit sanitaire.
E3C : enseignement de spécialité première générale.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
.
|
|
Choix
d'un moyen de transport.
1. Voiture diesel ou
voiture essence ?
Les émissions de dioxyde de carbone dues aux transports dépendent,
entre autres, du carburant utilisé. On se propose, en répondant aux
questions de cette première partie, de construire un argumentaire
scientifique permettant de valider ou d’invalider cette affirmation.
Les deux carburants étudiés sont le gasoil et l’essence sans plomb. On
admet qu’ils sont respectivement modélisés par du dodécane (C12H26)
pour l’un et de l’octane (C8H18) pour l’autre.
Un véhicule diesel consomme 5,0 L de gasoil aux 100 km et produit 120g
de CO2 par kilomètre parcouru.
1.1.L’équation de
la réaction modélisant la combustion du dodécane s’écrit :
C12H26 (l) + 18,5 O2 (g) -->
12 CO2 (g) + 13 H2O (g)
1.1.1. Représenter
le schéma de Lewis du dioxygène, du dioxyde de carbone et de l’eau.
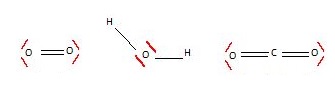
1.1.2. Déterminer
la quantité de matière de dioxyde de carbone rejeté par la voiture
diesel par kilomètre parcouru.
120 / M(CO2) = 120 / 44 = 2,73 mol.
1.1.3. En déduire
la quantité de matière de dodécane consommé par kilomètre parcouru.
2,73 / 12 = 0,227 mol.
1.1.4. Montrer, à
l’aide des données, qu’une estimation de l’énergie molaire de
combustion du dodécane est E’m = - 7,50 103 kJ.mol-1.
Indiquer pourquoi il s’agit d’une estimation.
Liaisons rompues : 26 C-H ; 11 C-C et 18,5 O=O.
Liaisons formés : 24 C=O et 26 O-H.
E'm =26 E C-H +11 E C-C +18,5 EO=O
-(24 EC=O +26 EO-H).
E'm =26 x415 +11 x348 +18,5 x498 -(24 x804 +26 x463)= -7,5 10-3
kJ / mol.
Il s'agit d'une estimation, car dans la réalité la combustion n'est pas
toujours complète.
1.1.5. En déduire
l’énergie libérée Elib par la combustion du gasoil pour un
kilomètre parcouru.
Elib = -7,50 103 x0,227 = -1,7 103 kJ.
1.2.Une voiture
essence de motorisation équivalente libère une énergie liée à la
combustion de l’essence E’lib = - 1,7 103 kJ par
kilomètre parcouru.
1.2.1. Montrer que
la masse de dioxyde de carbone émise par la voiture à essence par
kilomètre parcouru vaut m’ = 1,2 102 g.
Energie molaire de combustion de l'octane : E m = -5,1 103
kJ / mol.
Quantité de matièe d'octane par km parcouru : Em / E'lib
=1,7 / 5,1 =0,333 mol km-1.
Quantité de matièe de CO2 par
km parcouru : 8 x0,333 = 2,67 mol km-1.
Masse correspondante : 2,67 x44 =117 g km-1.
1.2.2. Commenter le résultat obtenu
et rédiger un conseil argumenté sur le choix du véhicule à utiliser
pour minimiser l’impact sur le réchauffement climatique. On s’attachera
notamment à montrer si le critère de la consommation par kilomètre
parcouru est un indicateur suffisant.
A puissance égale, la motorisation essence ou diesel produisent la même
quantité de dioxyde de carbone par kilomètre parcouru. critère
n'est pas à retenir pour le choix d'un véhicule, dans le but de limiter
l'impact sur le réchauffement climatique.
Il vaudrait mieux limiter le volume de carburant consommé en
s'orientant vers un véhicule hybride ou électrique.
2. Quel moyen de transport
choisir ?
Un salarié d’une entreprise de conseil en développement durable doit
effectuer un aller-retour Bordeaux-Paris pour aller défendre un projet
d’aménagement. Les deux villes sont distantes de d = 546 km. Soucieux
de l’environnement, il étudie les différentes solutions alternatives à
la voiture, comme le train (ligne TGV) et l’avion afin de réduire son
empreinte carbone.
L'empreinte « carbone » est la mesure de la quantité de dioxyde de
carbone émis, suite à la combustion d'énergies fossiles, par une
activité, un produit (depuis quelques années cette information est
disponible sur l'électroménager, les offres immobilières, les
véhicules), une prestation.
Le site « oui.sncf » propose un calculateur des émissions de dioxyde de
carbone lors d’un voyage en train. On y trouve notamment l’information
suivante :
Emissions de CO2 d’un voyageur parcourant un kilomètre, par
type de train SNCF (basées sur les consommations d’énergie (source :
Réseau de transport d’électricités (Rte), 2017) et fréquentations de
2017) :
Train TGV : 2,4 g de CO2 par kilomètre
Train Intercités : 8,1 g de CO2 par kilomètre
Train TER : 29,4 g de CO2 par kilomètre
Train Transilien / RER : 5,4 g de CO2 par kilomètre
D’après https://fr.wikipedia.org et https://www.oui.sncf.
Le combustible utilisé dans les moteurs d’avion est le kérosène. C’est
un mélange complexe d’alcanes, principalement des molécules comportant
11 atomes de carbone de formule brute C11H24.
Des calculateurs en ligne permettent d’évaluer la masse de CO2
émis par voyageur lors d’un voyage en avion.
Le résultat de la simulation est donné ci-dessous.
Aller retour Bordeaux paris 1100 km : quantité CO2 = 0,306
tonne.
En s’appuyant sur les informations données ci-dessus et les résultats
trouvés à la partie 1, réaliser une étude comparée qui permettra au
salarié de l’entreprise d’identifier, parmi les trois proposés, le mode
de transport le plus écologique au niveau des émissions de dioxyde de
carbone pour effectuer un aller-retour Bordeaux-Paris.
Avion : 0,306 tonne CO2.
Train TGV : 2,4 x2 x546 =2621 g = 2,62 kg de CO2.
Train intercités : 8,1 x2 x546 =8845 g = 8,84 kg de CO2.
Voiture : 120 x 2 x 546 =1,31 105 g = 131 kg CO2.
On prendra le train TGV.
|
|
Des
esters qui flattent nos cellules olfactives.
Cet exercice propose d’étudier quelques esters présents dans les arômes
alimentaires et de comparer les rendements d’une estérification
effectuée selon deux protocoles, l’un effectué avec un chauffage usuel
et l’autre sous micro-ondes.
1. L’arôme de fraise.
L’acide méthylpropanoïque est l’un des réactifs utilisés pour la
synthèse de l’ester A, il est présent parmi les trois composés oxygénés
E, F et G dont les formules semi-développées sont données ci-dessous.
1.1. Recopier les
formules des molécules de ces trois composés, puis entourer et nommer
les familles de composés associées.
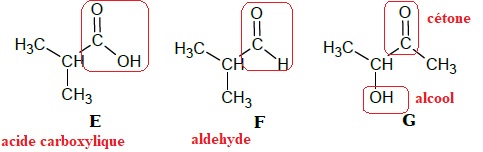
1.2. Identifier
l’acide méthylpropanoïque parmi les trois composés E, F et G. Justifier
son nom.
E : acide méthylpropanoïque.
La chaine principale compte trois atomes de carbone ; elle rappelle
celle du propane.
Un groupe méthyle CH3 est fixé sur le carbone n° 2.
Il s'agit d'un acide carboxylique. On ajoute le mot acide devant le nom
et le "e" terminal du mot propane est remplacé par " oïque".
2. L’arôme d’agrumes.
Le composé H, dont une formule est représentée ci-après, est un des
réactifs utilisés pour synthétiser l’ester B à l’arôme d’agrumes.
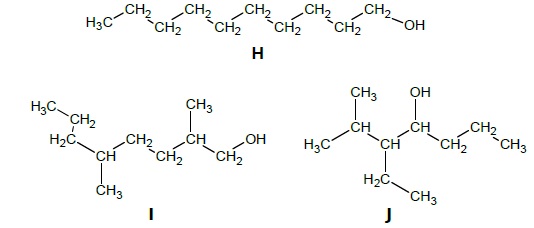
2.1. Les composés
H, I et J sont-ils des isomères ? Justifier.
Il possède la même formule brute C10 H22 O
et des formules semi-dévelopées différentes : ce sont des isomères.
2.2. Le composé H
est appelé décan-1-ol. Justifier son nom.
10 atomes de carbone sur une chaine linéaire ( non ramifiée) et une
fonction alcool en bout de chaine.
2.3. Représenter,
sur votre copie, la formule topologique du composé I, puis entourer sa
chaîne carbonée la plus longue et nommer le(s) groupe(s) substitués(s)
sur cette chaine et caractéristique(s) éventuel(s).
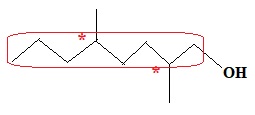
2 groupes méthyle et un groupe hydroxyle sont substitués sur la plus
longue chaine carbonée.
Les atomes de carbone 2 et 5 sont asymétriques.
3. Synthèse d’un ester à
l’arôme d’ananas : comparaison des rendements obtenus par deux
protocoles différents
L’équation de la réaction modélisant la synthèse de l’ester D de
formule brute C6H12O2 présent dans
l’arôme d’ananas est :
C4 H8O2(l) + C2H6O(l)
-->C6H12O2(l) + H2O(l).
Il est possible de réaliser la synthèse de l’ester D selon deux
protocoles.
Protocole n°1
: synthèse par chauffage à reflux.
Ce protocole permet d’obtenir un rendement maximal de 67% si les deux
réactifs sont introduits en quantités de matière égales. Pour
l’augmenter, il est possible entre autres, d’introduire l’un des
réactifs en excès. C’est le choix fait dans le protocole qui suit.
Introduire dans un ballon, 40,0 mL d’éthanol, 40,0 mL d’acide
butanoïque et 1,0 mL d’acide sulfurique concentré.
Chauffer à reflux pendant 30 min
Refroidir jusqu’à température ambiante puis verser le contenu du
ballon dans un bécher contenant 100 mL d’eau salée.
Transvaser le mélange dans une ampoule à décanter.
Isoler et laver la phase organique. On obtient une masse de 35,7 g
d’ester.
Protocole n°2
: synthèse sous micro-ondes
Pour ce protocole, on choisit délibérément de mélanger les deux
réactifs en quantités de matière égales.
Introduire dans un bécher, 25,4 mL d’éthanol (soit 4,36 x 10-1
mol), 40 mL d’acide butanoïque (soit 4,36 x 10-1 mol) et 1
mL d’acide sulfurique concentré.
Placer le bécher dans le four à micro-ondes et irradier la solution
par de courtes périodes à 1000 W.
Transvaser le mélange dans une ampoule à décanter.
Isoler et laver la phase organique. On obtient une masse de 47,5 g
d’ester.
3.1. Étude du
protocole n°1
3.1.1. Légender le
schéma du dispositif de chauffage à reflux. Et décrire le rôle de
chacun de ces éléments.
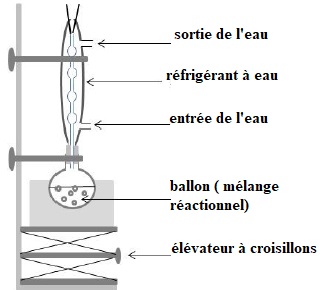
Les vapeurs se condensent dans le réfrigérant à eau et retombent
dans le milieu réactionnel.
L'élévateur à croisillons permet de monter ou descendre le ballon.
3.1.2. Expliquer
l’intérêt de verser, après les 30 min de chauffage, le mélange
réactionnel refroidi dans de l’eau salée.
L'ester est insoluble dans l'eau salée. Il se sépare de la phase
aqueuse.
3.2. Détermination
du rendement obtenu en suivant le protocole n°1.
3.2.1. Déterminer
le réactif limitant lors de la mise en oeuvre du protocole n°1.
Ethanol : 40 mL ; masse volumique : 0,79 g / mL ; masse molaire : 46 g
/ mol.
n(éthanol) = 40 x 0,9 / 46 =0,78 mol.
Acide butaanoïque : 40 mL ; masse volumique :0,96 g / mL ; masse
molaire 88 g / mol.
n(acide butanoïque) = 40 x 0,96 / 88 =0,44 mol ( en défaut, réactif
limitant ).
3.2.2. En déduire
le rendement de la synthèse. Commenter.
On peut espérer au mieux obtenir 0,44 mol d'ester.
M(ester) = 116 g / mol ; masse = 0,44 x 116 =50,6 g.
Rendement : masse réelle / masse théorique = 35,7 / 50,6 ~0,71 ( 71 %).
En introduisant un réactif en excès, le rendement augmente.
3.3. Calculer le
rendement de la synthèse obtenu à partir du protocole n°2.
On peut espérer au
mieux obtenir 0,436 mol d'ester.
M(ester) = 116 g / mol ; masse = 0,436 x 116 =50,6 g.
Rendement : masse
réelle / masse théorique = 47,5 / 50,6 ~0,94 ( 94 %).
Proposer, en quelques
lignes, une analyse comparative critique des deux protocoles.
Lors de l'utilisation du micro-ondes, on élimine une partie de l'eau
formée, ce qui déplace l'équilibre dans le sens direct, formation de
l'ester.
Le protocole n°2 est plus facile à mettre en oeuvre, mais il comsomme
sans doute plus d'énergie électrique.
|
Teneur en
fer d'un produit sanitaire.
La teneur en fer d’un produit phytosanitaire anti-chlorose est indiquée sur son emballage : 6,0 % en masse.
L’objectif de cet exercice est d’envisager un titrage par spectrophotométrie adapté au contrôle de qualité de ce produit.
1. Choix du réactif titrant.
Pour réaliser le titrage des ions ferreux, Fe2+, contenus
dans un produit phytosanitaire destiné à lutter contre la chlorose
ferrique, on dispose de deux solutions titrantes possibles :
Une solution de peroxodisulfate de potassium acidifiée (2K+(aq)+S2O82-(aq)) de concentration 0,10 mol.L-1.
Une solution de permanganate de potassium acidifiée (K+(aq)+MnO4-(aq)) de concentration molaire 0,10 mol.L-1.
Les ions peroxodisulfate comme les ions permanganate réagissent en solution aqueuse avec les ions Fe2+. Un test avec une solution aqueuse d’hydroxyde de sodium, après réaction entre
les ions Fe2+ et les ions S2O82- ou MnO4- , conduit au même précipité rouille d’hydroxyde de fer(III)..
1.1.Préciser la nature de la transformation chimique qui se produit quand on mélange des ions Fe2+ et des ions peroxodisulfate S2O82- d’une part ou permanganate MnO4- d’autre part, que
le test avec une solution aqueuse d’hydroxyde de sodium met en évidence.
Oxydation des ions Fe2+ en ion Fe3+.
1.2.Écrire les équations des réactions modélisant les transformations chimiques mettant en jeu :
les ions Fe2+ et les ions S2O82- d’une part,
les ions Fe2+ et les ions MnO4-d’autre part.
2Fe2+ aq--> 2Fe3+aq + 2e-.
S2O82- aq + 2e- --> 2SO42-aq.
Ajouter puis simplifier : 2Fe2+ aq + S2O82- aq --> 2Fe3+aq +2SO42-aq.
5 fois { Fe2+ aq-->Fe3+aq + e- }
MnO4- aq +8H+aq +5e- --> Mn2+aq +4H2O
MnO4- aq +8H+aq +5e- + 5Fe2+ aq--> Mn2+aq +4H2O +5Fe3+aq +5e- .
MnO4- aq +8H+aq + 5Fe2+ aq--> Mn2+aq +4H2O +5Fe3+aq .
1.3.Montrer,
en vous référant à la couleur de chaque solution titrante, qu’il est
plus judicieux de choisir la solution de permanganate de potassium pour
réaliser le titrage des ions
ferreux contenus dans le produit phytosanitaire, la coloration due aux ions ferreux (Fe2+) ou ferrique (Fe3+) en solution aqueuse étant très peu perceptible.
Seul l'ion permanganate possède une forte coloration violette, les autres ions sont incolores.
1.4.Définir l’équivalence d’un titrage.
A l'équivalence les réactifs sont en proportions stoechiométriques.
Avant l'équivalence, le réactif titré est en excès, après l'aquivalence
le réactif titrant est en excès.
2. Mise en oeuvre du titrage
2.1.La
solution de permanganate de potassium étant trop concentrée, il est
nécessaire de la diluer 5 fois avant de l’utiliser pour le titrage.
Choisir la verrerie adaptée à cette dilution. Justifier.
Le volume de la fiole jaugée (50,0 mL par exemple) doit être 5 fois plus grand que celui de la pipette jaugée ( 10,0 mL).
2.2.Expliquer
pourquoi certaines verreries sont associées à des capacités notées 100
mL, 50 mL, 10 mL, et d’autres à des capacités de 100,0 mL, 50,0 mL,
10,0 mL.
Les verreries de capacités 100 mL, 50 mL .. sont moins précises que les verreries de capacités 100,0 mL, 50,0 mL...
2.3.Le
produit phytosanitaire se présente sous la forme d’une poudre. Afin de
réaliser le titrage, on dissout 100,0 g de produit dans de l’eau et on
complète avec de l’eau de façon
à obtenir 1,0 L de solution.
2.3.1.
On prélève 10,0 mL de cette solution qu’on introduit dans un
erlenmeyer. Choisir la verrerie utilisée pour prélever ces 10,0 mL.
Pipette jaugée de 10,0 mL.
2.3.2. Schématiser et légender le montage utilisé afin de réaliser le titrage.
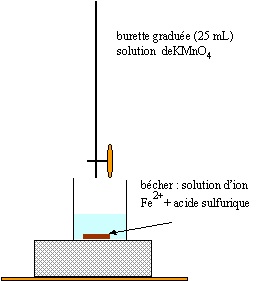
3. Exploitation du résultat du titrage
3.1.Le titrage est réalisé plusieurs fois. On note VE,
le volume de solution de permanganate de potassium versé pour atteindre
l’équivalence pour chaque titrage réalisé. Les résultats
sont rassemblés dans le tableau suivant :
Mesure
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
VE (mL)
|
11,0
|
10,6
|
10,4
|
10,6
|
10,8
|
10,5
|
10,7
|
10,9
|
11,2
|
11,0
|
3.1.1. L’incertitude-type u(VE), de type A, sur cette série de mesures est égale à 0,080 mL. Écrire le résultat de la mesure pour VE.
Valeur moyenne de VE : 10,77 mL.
VE =10,77 ± 0,080 mL.
3.1.2.
Une autre méthode de détermination de l’incertitude-type sur le volume
équivalent aurait pu être prise en compte. Préciser sa nature.
u(VE) = écart type / 10½ ou encore :
u(VE) / VE =[( précision sur la concentration de la solution titrante / concentration solution titrante ) 2 + (précision sur le volume de la solution titrée / volume solution titrée ) 2]½.
3.1.3. Déterminer la teneur en masse d’ions ferreux présente dans l’échantillon de 10,0 mL de solution titrée prélevé.
A l'équivalence, quantité de matière d'ion permanganate : n =10,77 x 0,10 / 5 = 0,2154 mmol.
Quantité de matière d'ion fer (II) : 5 x0,2154 =1,077 mmol dans 10,0 mL.
Concentration en ion fer (II) : 1,077 /10 = 0,1077 mol / L.
Concentration masique : 0,5385 x M(Fe) = 0,1077 x 56,0 =6,03 ~6,0 g / L dans 100 g de poudre. ( environ 6 % en masse ).
3.2.
Un titrage par spectrophotométrie peut-il être adapté au contrôle de la
teneur en fer du produit phytosanitaire indiquée sur l’emballage ?
Il faudrait que l'ion Fe2+ soit le seul ion présentant un maximum d'absorption dans le domaine UV visible.
C'est possible, en présence d'o-phénanthroline, les ions Fe2+ réagissent avec apparition d'une coloration rouge. La concentration des ions Fe2+ de cette solution peut alors être déterminée par la mesure de son absorbance à une certaine longueur d'onde (ici 500 nm ).
|
|
|





