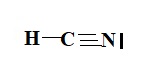Physique
chimie, aspects énergétiques des phénomènes électriques, l'allantoïne,
détection du tabagisme passif.
E3C : enseignement de spécialité première générale.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
.
|
|
Aspects
énergétiques des phénomènes électriques.
Partie 1 :
consommation énergétique des appareils électroménagers
1.1. En utilisant
vos connaissances, choisir un ordre de grandeur pour la puissance de la
machine à café parmi les trois propositions suivantes : a : 10 W ; b : 1 kW (vrai) ; c : 100 kW.
1.2. Nommer le
phénomène physique commun mis en jeu pour griller les tartines dans le
grille-pain ou pour chauffer l’eau de la machine à café ou de la
bouilloire.
Effet Joule.
1.3. Calculer la
consommation supplémentaire d’énergie qu’apporterait l'usage de la
machine à café et du grille-pain (puissance 1,5 kW) sur une
année. En déduire la dépense engendrée en euros sur une année.
La famille compte utiliser le grille-pain 5 minutes par jour tous les
jours lors du petit-déjeuner.
Les deux parents prennent chacun un café par jour. ( 30 secondes pour
faire un expresso).
Durée de fonctionnement annuel du grille pain : 5 x365 / 60 = 30,4 h.
Energie consommée : 1,5 x 30,4 = 45,6 kWh.
Durée de fonctionnement annuel de la machine à café : 365 /60
=6,08 h.
Energie consommée : 1 x6,08 ~6,1 kWh.
Total : 30,4 +6,08 ~36,5 kWh.
Prix du kWh : 0,15 €.
Dépenses supplémentaires : 36,5 x0,15 ~5 5 €.
Partie 2 : rendement de la
bouilloire.
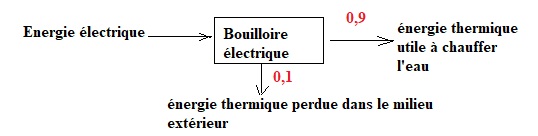
2.1. Pourquoi
peut-on qualifier le grille-pain ou la bouilloire de convertisseurs
d’énergies ?
Ils reçoivent de l'énergie électrique et la convertissent en énergie
thermique.
2.2. Définir le
rendement d’un convertisseur. Expliquer sans calcul pourquoi le
rendement de ces deux appareils électriques n’est pas de 100 %.
Rendement = énergie utile / énergie consommée.
Une partie de l'énergie thermique chauffe l'appareil et l'air extérieur.
2.3. La bouilloire
( P = 2,2 kW) contient un volume V = 0,60 L d’eau initialement à la
température T1 = 20 °C et la chauffe à la température T2
= 90 °C en 1 min 30 s. Calculer le rendement. Établir un bilan
énergétique relatif à la bouilloire sous la forme d’un schéma
énergétique. Commenter.
Energie reçue par l'eau : meau Ceau ( T2-T1)
=0,60 x 4,18 x(90-20) = 176 kJ.
Energie électrique consommée : P Dt = 2,2 x(60+30) =198 kJ.
Rendement : 176 / 198 ~0,89 ( 89 %).
Partie 3 : modélisation
d’une résistance chauffante au laboratoire.
La résistance chauffante d’une bouilloire peut être assimilée à un
conducteur ohmique.
Au laboratoire, on dispose d’un conducteur ohmique immergeable de
résistance R que l’on place dans un calorimètre (récipient fermé et
isolé thermiquement ; les échanges d’énergie thermique avec l‘extérieur
sont ainsi très faibles).
La résistance est en série avec un générateur de tension, de force
électromotrice E, ainsi qu’un rhéostat de résistance variable R’ = 33
Ω. Le calorimètre est rempli d’un volume V d’eau.
Un voltmètre indique la valeur de la tension aux bornes de la
résistance immergeable : U = 12,18 V.
L’ampèremètre indique que la valeur de l’intensité dans le circuit est
I = 2,26 A.
On mesure également la valeur de la température de l’eau à l’aide d’un
thermomètre électronique.
Initialement la température de l’eau est T1 = 28,1 °C.
On déclenche le chronomètre au moment où allume le générateur. Les
résultats sont consignés dans le tableau ci-dessous.
t(s)
|
60
|
120
|
180
|
240
|
300
|
360
|
420
|
480
|
540
|
température
T de l'eau (°C)
|
29,1
|
29,8
|
30,5
|
31,8
|
32,5
|
33,4
|
34,3
|
35
|
35,9
|
T-T1
°C
|
1
|
1,7
|
2,4
|
3,7
|
4,4
|
5,3
|
6,2
|
6,9
|
7,8
|
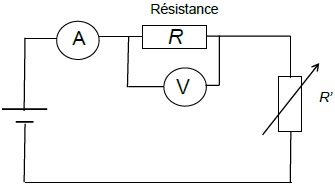
3.1. Calculer la
valeur de la résistance R immergeable.
R = U / I = 12,18 / 2,26 =5,39 ohms.
3.2. Compléter le
programme écrit en langage Python aux lignes 2, 3 et 4 afin que
celui-ci réalise le tracé de l’écart de température T-T1 en
fonction du temps exprimé en secondes.
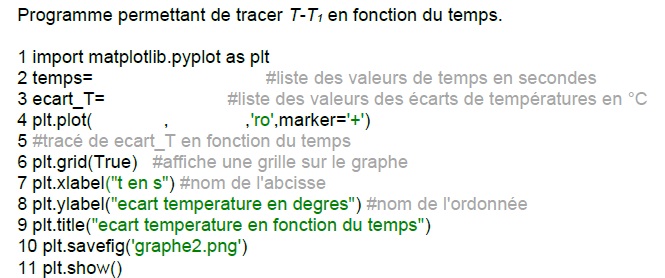
Ligne 2 temps =(60, 120, 180, 240, 300, 360, 420 , 480, 540)
Ligne 3 écart_T=(1, 1,7, 2,4,3,7, 4,4, 5,3, 6,2, 6,9, 7,8)
Ligne4 plt.plot(temps, ecart_T, 'ro',marker='+')
Le graphe représentant T-T1 en fonction du temps est donné
ci-après.
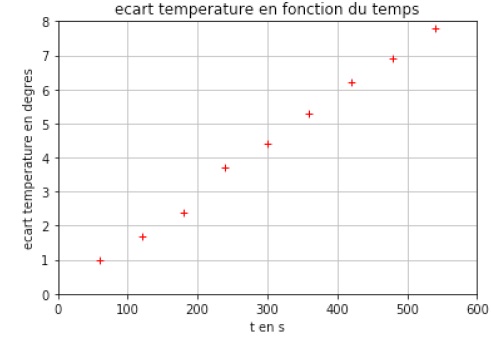
3.3. On montre que :
(T−T1 )= R. I 2 t / (mc).
avec m la masse d’eau introduite, c la capacité thermique massique de
l’eau. Déterminer la valeur du volume d’eau V introduit dans le
calorimètre à l’aide du graphe. On prendra R = 5,4 Ω.
Le graphe est une droite de coefficient directeur 4,35 / 300 ~0,0145 °C
s-1.
T-T1 =0,015 t.
On identifie 0,0145 à RI2 /( mc).
m = RI2 /(0,0145 c) =5,4 x2,262 /(0,0145
x4180)=0,455 kg ( Volume d'eau : 0,455 L).
|
|
Allantoïne.
L’objectif
de l’exercice est d’étudier l’acide glyoxylique et l’urée, puis un
protocole de synthèse de l’allantoïne au laboratoire.
1. À propos de l’acide
glyoxylique.
L’acide glyoxylique est un solide, très utilisé dans l’industrie.
1.1.Recopier sur la
copie la formule semi-développée de la molécule d’acide glyoxylique et
identifier les groupes caractéristiques qui la composent.
1.2.Représenter le
schéma de Lewis de la molécule.
1.3.Donner, en
justifiant, la géométrie de cette molécule autour de l’un ou l’autre
des atomes de carbone.
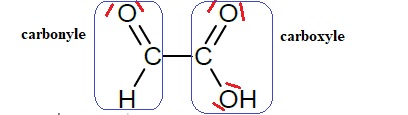
Autour de chaque atome de carbone il y a trois directions de
liaisons ; les carbone ne portent pas de doublets non liants.
La géométrie de chaque carbone est triangulaire.
2. A propos de l’ammoniac
et urée.
L’urée est un composé organique de formule chimique semi-développée : H2N
– CO – NH2
L’urée naturelle fut découverte en 1773 par le pharmacien Hilaire
Rouelle. Formée dans le foie, à partir de l’ammoniac, NH3,
provenant de la dégradation d’acides aminés, l’urée naturelle est
éliminée au niveau des reins par l’urine.
En 1828, le chimiste allemand Friedrich Wöhler réussit à synthétiser en
laboratoire l’urée, molécule dite « organique » à l’époque, à partir
d’ammoniac. On considérait avant cette synthèse que les molécules «
organiques » ne pouvaient provenir que de constituants ou de
dérivés d’organismes vivants habités par la « force vitale » (vis
vitalis). Cette date, gravée dans l’histoire, est retenue comme étant
celle fondatrice de la chimie organique. D’après
http://www.societechimiquedefrance.fr/uree.html
2.1.Donner la
configuration électronique de l’azote N et de l’hydrogène H. En déduire
la géométrie de la molécule d’ammoniac.
H : 1 s1 ; N 1s2 2s2 3p3.
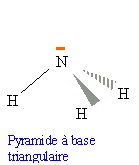
2.2. Justifier le
caractère polaire de la molécule d’ammoniac.
L'atome d'azote est plus électronégatif que l'atome d'hydrogène. Les
liaisons N-H sont polarisées. L'atome d'azote porte un doublet non
liant. L'ammoniac est une molécule polaire.
2.3.On s’intéresse
au spectre Infrarouge de l’urée.
2.3.1. Nommer la
grandeur qui figure en abscisse du spectre Infrarouge.
Nombre d'onde en cm-1.
2.3.2. Que confirme
la bande la plus à gauche du spectre ?
Liaison C-NH2 double forte.
2.3.3. Repérer la
bande du spectre qui confirme la présence d’une liaison C = O.
Peut-elle être attribuée sans ambiguïté à la liaison C=O de l’urée ?
Justifier.
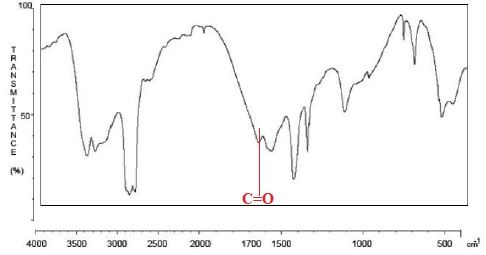
Oui, la bande C=O d'un aldehyde ou d'un acide carboxylique se situe un
peu plus haut.
3. Synthèse de l’allantoïne.
Une voie de synthèse de l’allantoïne s’effectue à partir d’urée et
d’acide glyoxylique et peut être modélisée par une réaction chimique
d’équation suivante :
2 CH4N2O(s) + C2H2O3(aq)
→ C4H6 N4O3(s) + 2 H2O(l)
Le protocole expérimental d’une synthèse de l’allantoïne, réalisée au
laboratoire, est décrit ci-après.:
a. Placer un barreau aimanté dans un erlenmeyer de 100 mL puis, à
l’aide d’un entonnoir à solide, verser 13,6 g d’urée et 10,0 mL de
solution aqueuse d’acide glyoxylique à 50% en masse. Agiter jusqu’à
l’obtention d’une solution limpide. Introduire lentement 1,5 mL d’acide
sulfurique concentré, sous agitation magnétique. L’acide sulfurique a
pour rôle d’accélérer la réaction. Adapter un réfrigérant ascendant.
b. Placer l’erlenmeyer dans un bain-marie. Maintenir l’agitation, le
chauffage et l’ébullition de l’eau du bain-marie pendant 45 minutes. Le
milieu réactionnel se trouble au bout de 15 à 20 minutes avec
l’apparition d’un précipité blanchâtre.
c. Plonger ensuite le bécher dans de la glace pendant quelques minutes.
Récupérer le solide à l’aide d’un dispositif de filtration sous vide de
type Büchner.
d. Laver avec suffisamment d’eau glacée. Sécher à l’étuve le temps
nécessaire. e. Peser le solide obtenu.
3.1.Associer aux
différentes étapes (a, b, c, d, e) mises en oeuve les différentes
étapes d’un protocole de synthèse : transformation ; séparation,
purification, analyse.
b : transformation ; c : séparation ; d : purification.
3.2.Préciser
Expliquer l’apparition progressive du précipité blanchâtre.
L'allantoîne est peu soluble dans l'eau chaude ( 150 g / L dans l'eau
bouillante).
3.3.Justifier
l’utilisation de la glace dans l’étape c.
L'allantoîne est
très peu soluble dans l'eau froide ( 5 g / L).
3.4. Justifier l’intérêt de laver à
l’étape d du protocole, le solide obtenu avec suffisamment d’eau glacée.
Eliminer le réactif en excès et l'acide sulfurique solubles dans l'eau.
3.5. Déterminer le
rendement de la synthèse ainsi effectuée, sachant que la masse
d’allantoïne sèche obtenue vaut m = 8,60 g.
Quantité de matière d'urée : 13,6 / M(urée) =13,6 / 60 = 0,227 mol.
Quantité de matière d'acide glycolique à 50 % en masse ( r = 1,3 g / mL):
masse : 10,0 x1,3 = 13,0 g ; 13,0 / M(acide glycolique) = 13,0 /
74 = 0,176 mol.
Une mole d'acide glycolique réagit averc 2 moles d'urée.
0,176 mol d'acide glycolique réagit avec 2 x0,176 = 0,351 mol d'urée.
L'urée est donc en défaut.
On peut espérer obtenir au mieux 0,227 /2 =0,114 mol d'allantoïne soit
0,114 x M( allantoïne) = 0,114 x158,1=17,9 g.
Rendement = masse réelle / masse théorique = 8,60 / 17,9 ~0,48 (
48 %).
|
Le tabagisme passif.
Le
tabagisme passif est défini comme l'inhalation involontaire de la fumée
de tabac présente dans l'air. Dans cette partie on cherche à déterminer
si une femme enceinte est victime d’un
tabagisme passif.
1. Après avoir
recopié la formule semi-développée de chacune des quatre molécules
représentées, identifier le groupe caractéristique présent et
l’associer à une
famille de composés.
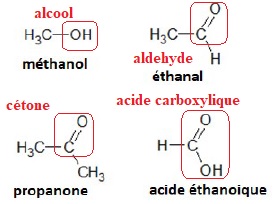
2. Justifier le nom donné à la propanone.
Trois atomes de carbone, ce qui rappelle la structure du propane.
Un groupe carbonyl sur le carbone central. On remplace le "e" terminal de propane par la terminaison "one".
3. Établir le schéma de Lewis de la molécule de cyanure d’hydrogène de formule HCN et proposer une géométrie pour cette molécule.
H : un électron de valence, donc une liaison.
C : 4 électrons de valence donc 4 liaisons.
N : 5 électrons de valence, donc trois liaisons et un doublet non liant.
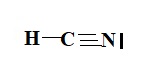
Carbone central : deux directions de liaisons et aucun doublet non liant, donc structure linéaire.
Le cyanure d’hydrogène est absorbé par le corps, puis en partie dégradé en ions thiocyanate SCN− que l’on retrouve ensuite dans la salive ou dans l’urine. Dans la salive, par exemple, les
concentrations en masse en ions thiocyanate sont en moyenne de 112 mg·L-1 chez les non fumeurs et de 349 mg·L-1 chez les fumeurs. Les ions thiocyanate peuvent donc être considérés
comme des marqueurs biologiques du tabagisme car leur concentration
renseigne sur l’exposition d’une personne à la fumée du tabac.
Principe du dosage.
Un échantillon noté S de 250 μL de salive d’une femme enceinte est
prélevé. Les ions thiocyanate présents dans l’échantillon étant
incolores et n’absorbant pas dans le proche
ultraviolet, on les fait réagir avec une solution d’ions fer III, Fe3+(aq). On obtient 10,0 mL d’une solution S’ dans laquelle s’est formée l’espèce ionique de formule Fe (SCN )2+, soluble dans
l’eau. La transformation chimique est modélisée par la réaction d’équation suivante :
SCN-(aq) +Fe3+aq --> Fe(SCN)2+aq.
La courbe ci-dessous représente l'absorbance d'une solution aqueuse contenant l’espèce ionique Fe (SCN )2+ en fonction de la longueur d'onde.
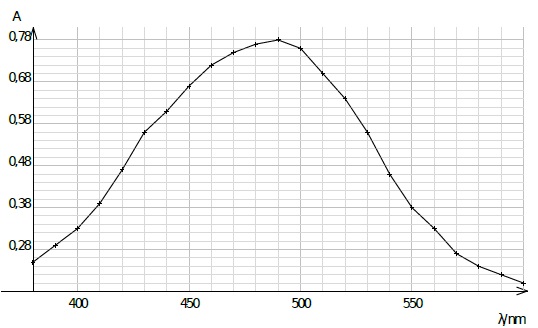
4. Expliquer
pourquoi les ions thiocyanate ne peuvent pas être dosés directement par
spectrophotométrie UV-visible. Indiquer l’intérêt de les faire réagir
avec les ions Fe3+aq.
Ils sont incolores et n'absorbent pas dans le proche UV. Par contre Fe (SCN )2+ présente un maximum d'absorption vers 490 nm (bleu)..
Préparation de la gamme de solution étalon et tracé de la droite d’étalonnage
On cherche à doser l’espèce chimique Fe (SCN )2+présente dans la solution S’.
À partir d’une solution S0 de concentration C0 = 2,0×10−4 mol.L-1 en ions Fe (SCN )2+, on prépare la gamme d’étalonnage composée des solutions S0, S1, S2, S3 et S4 dont les concentrations sont
données dans le tableau ci-dessous.
Solution
|
S0
|
S1
|
S2
|
S3
|
S4
|
[ Fe (SCN )2+] mol / L
|
2,0 10-4
|
1,6 10-4
|
1,0 10-4
|
0,80 10-4
|
0,40 10-4
|
5. Indiquer la verrerie nécessaire pour préparer 50,0 mL de solution S2 à partir de la solution S0 en justifiant votre raisonnement.
Facteur de dilution : F = 2.
Fiole jaugée de 50,0 mL et pipette jaugée de 50 / 2 = 25,0 mL.
On mesure l’absorbance de chacune des solutions et on trace le
graphique ci-dessous donnant l’évolution de l’absorbance en fonction de
la concentration en ions Fe(SCN)2+.
6. Après avoir
rappelé l’expression de la loi de Beer-Lambert en indiquant les unités
des grandeurs, déterminer si les résultats expérimentaux obtenus sont
en accord avec cette loi.
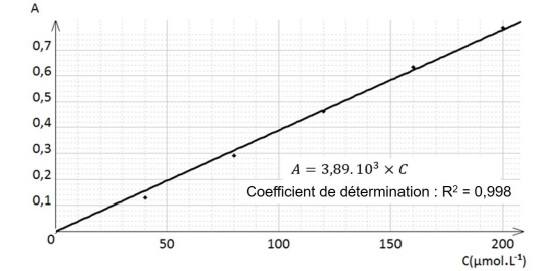
L'absorbance A ( grandeur sans unité) est proportionnelle à la concentration C ( mol / L).
Le graphe est une droite passant par l'origine, cette loi est donc vérifiée.
Détermination de la concentration en ions thiocyanate dans la salive.
Dans la solution S’ tous les ions thiocyanate contenus dans la salive de la femme enceinte ont réagi avec les ions Fe3+ présents en large excès. L'absorbance de la solution S’ a pour valeur
A = 0,65.
7. Déterminer la concentration en quantité de matière des ions Fe (SCN )2+dans la solution S’. En déduire leur quantité de matière dans la solution de volume V = 10,0 mL.
C = 0,65 / (3,89 103) =1,67 10-4 ~1,7 10-4 mol / L.
Soit 1,7 10-4 x0,010 = 1,7 10-6 mol.
8. Recopier et
compléter le tableau d’avancement ci-dessous. En déduire la relation
entre la quantité de matière des ions Fe (SCN )2+ à la fin de la transformation et la quantité de
matière en ions SCN−initialement présente dans la solution.
|
avancement (mol)
|
SCN-(aq)
|
+Fe3+aq |
--> Fe(SCN)2+aq |
initial
|
x=0
|
1,7 10-6
|
excès
|
0
|
final
|
xmax =1,7 10-6
|
0
|
1,7 10-6
|
9. Déterminer la valeur de la concentration en masse des ions thiocyanate SCN− dans l’échantillon de salive de la femme enceinte et conclure sur le potentiel tabagisme passif de
cette femme.
1,7 10-6 mol d'ion SCN- dans 250 10-6 L de salive.
Concentration : 1,7 / 250 =6,8 10-3 mol / L.
M(SCN-) = 58,0 g / mol.
Concentration massique : 6,8 10-3 x 58,0 =0,394 g / L = 394 mg / L.
Cette valeur étant supérieure à 349 mg / L, la femme a été exposée au tabagisme.
|
|
|