Physique
chimie, le vert malachite, entretien de l'eau d'une piscine,
une éolienne à la maison.
E3C : enseignement de spécialité première générale.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
.
|
|
Le vert
malachite.
Cet exercice a pour
objectif d’étudier :
- la synthèse du vert malachite ;
- certaines précautions d’utilisation du vert malachite en
aquariophilie.
1. Synthèse du vert
malachite.
La première étape de la synthèse du vert malachite au laboratoire
consiste à chauffer à reflux pendant 10 minutes, le mélange suivant :
4,0 mL de benzaldéhyde, 4,0 mL de diméthylaniline, 3 g de chlorure de
zinc et quelques grains de pierre ponce.
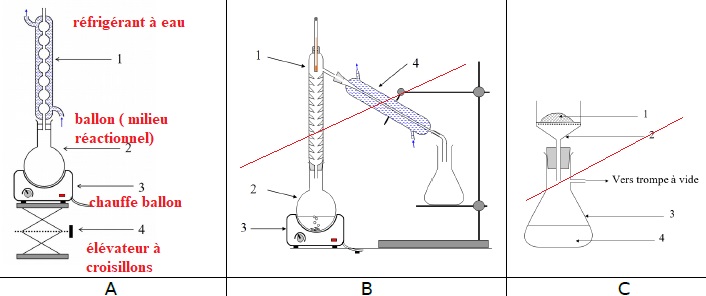
1.1.Choisir, parmi
les montages suivants, celui qui permet de réaliser un chauffage à
reflux.
1.2.Légender le
schéma du montage choisi à la question précédente.
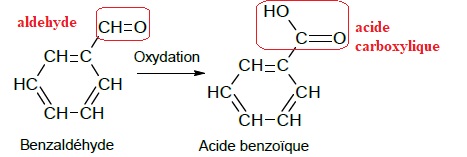
Un des réactifs de la synthèse est le benzaldéhyde. Le benzaldéhyde est
susceptible de s’oxyder à l’air en acide benzoïque lorsque le flacon
est ouvert ; la transformation est représentée ci-dessous. Il convient
donc de vérifier la pureté du benzaldéhyde avant de l’utiliser comme
réactif.
1.3.Reproduire
sur votre copie les formules du benzaldéhyde et de l’acide benzoïque,
puis pour chacune entourer le groupe caractéristique et l’associer à
une famille de composés.
1.4.Après avoir
défini une oxydation, justifier que le passage du benzaldéhyde à
l’acide benzoïque est une oxydation.
Un réducteur cède un ou plusieurs électrons : il s'oxyde.
C7H6O +H2O--> C7H6O2+2H++2e-.
1.5.Associer
à chacune des deux molécules (benzaldéhyde et acide benzoïque) l’un des
spectres infrarouge reproduits ci-après en expliquant la démarche
suivie.
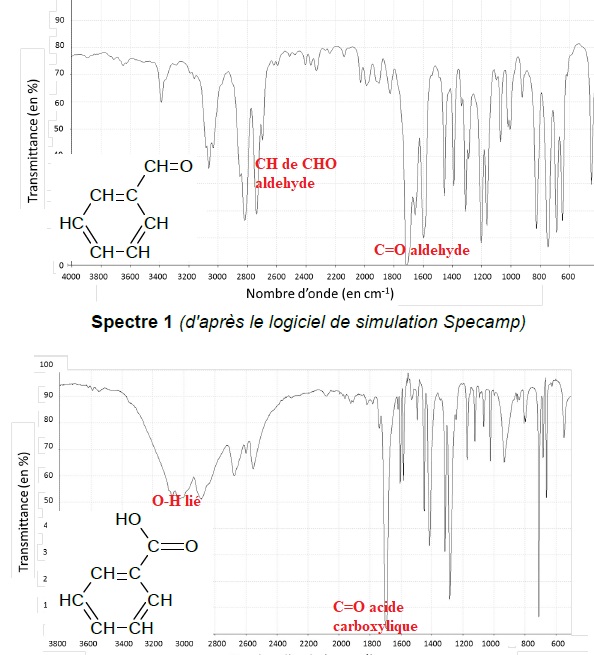
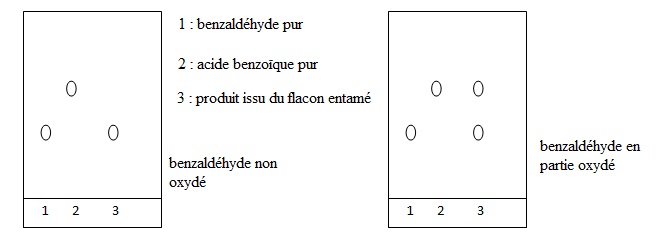
Pour
vérifier la pureté du benzaldéhyde dans le flacon entamé, il est
possible de mettre en oeuvre une chromatographie sur couche mince (CCM).
1.6.Indiquer
les dépôts qui pourraient être effectués sur la plaque de
chromatographie pour effectuer cette analyse et l’allure du
chromatogramme obtenu si le benzaldéhyde est pur ou s’il est
partiellement oxydé.
2. Utilisation du vert
malachite en aquariophilie.
Le vert malachite peut être utilisé comme traitement contre la maladie
des « points blancs » contractée par les poissons dans les bassins
d’eau douce, mais il est nécessaire d’éliminer le surplus de vert
malachite à la fin du traitement en utilisant du charbon actif. Pour
cela, une analyse de l’eau du bassin est réalisée pour déterminer la
concentration restante en vert de malachite.
2.1.Déterminer la
valeur de la concentration en quantité de matière apportée de vert
malachite, de la solution aqueuse fabriquée par le technicien dans
l’étape 1.
" J’ai préparé un volume V = 500 mL
d’une solution aqueuse à partir d’une masse m = 1,8 mg de vert
malachite solide."
M(vert de malachite) =364 g / mol.
n = 1,8 / 364 =4,94 10-3 mmol.
C = n / V = 4,94 10-3 / 500 ~9,9 10-6 mol / L.
2.2.Déterminer si
la modélisation effectuée à l’étape 3 est en accord avec la loi de
Beer- Lambert dont l’énoncé est attendu, ainsi que le nom des grandeurs
et des unités.
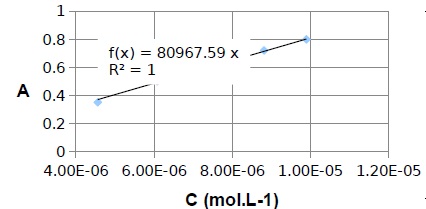
La courbe est une droite. La loi de Beer-Lambert est vérifiée.
L'absorbance A ( grandeur sans unité) est proportionnelle à la
concentration ( mol / L) de l'espèce absorbante.
Le volume du bassin est Vbassin = 1,2 × 104 L. On
considère ici que 1,0 g de charbon actif peut piéger au maximum 10 mg
de vert de malachite.
2.3.Déterminer le
nombre de sacs de charbon actif de 500 g que doit utiliser le
technicien pour éliminer le vert de malachite restant dans l’eau du
bassin.
" J’ai mesuré l’absorbance de l’eau
du bassin à la même longueur d’onde que les mesures précédentes. J’ai
trouvé Aeau-bassin = 0,67"
Concentration en vert de malachite : 0,67 / 80 968 ~8,3 10-6
mol / L.
Quantité de matière dans le bassin : 8,3 10-6 x 1,2 104
=9,93 10-2 mol.
Masse correspondante : 9,93 10-2 x 364 =36,1 g = 36,1 103
mg.
Masse de charbon actif : 3,6 103 g.
Nombre de sacs de charbon : 3,6 103 / 500 ~ 7 sacs.
|
|
Entretien
de l'eau d'une piscine.
Détermination de la
concentration en chlore libre d’une piscine
En solution aqueuse le « chlore libre » est incolore, rendant ainsi
impossible la détermination de sa concentration à l’oeil nu par les
particuliers.
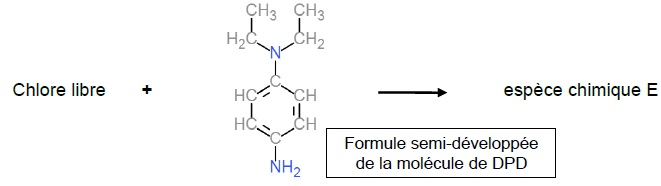
La méthode colorimétrique proposée ici est dite “ méthode au réactif
DPD ” (N,Ndiéthylphénylène- 1,4-diamine). La DPD réagit avec le «
chlore libre » pour former une espèce chimique colorée E dont
l’intensité de la coloration est proportionnelle à la concentration en
chlore libre pour des valeurs inférieures à 7,0 mg/L.
On peut modéliser la formation de l’espèce chimique colorée E par la
réaction 1 d’équation ci-dessous :
1.1. Déterminer la
couleur perçue de l’espèce chimique E produite lors de la réaction 1.
Justifier.
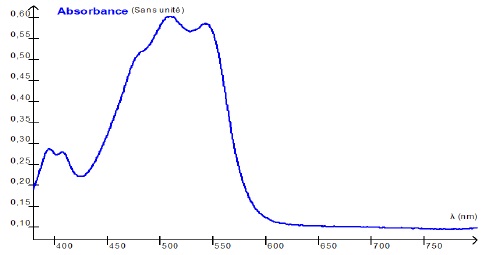
E présente un maximum d'absorption vers 500 -550 nm ( vert). E possède
la teinte complémentaire du vert, c'est à dire le pourpre.
1.2. Déterminer la
masse molaire de la DPD.et la quantité de matière de la DPD contenue
dans une pastille de 5,0 mg de DPD.
M(C10H16N2)=12 x 10 +16 +2x14=164
g/mol.
n = 5,0 10-3 / 164 =3,0488 10-5 ~3,0 10-5
mol.
1.3. Montrer que la
recommandation importante du fabricant du photomètre, permet d’affirmer
que la quantité de matière de chlore libre présente dans un tube test
de 10 mL ne doit pas dépasser 1,3x10-6 mol.
" Pour une concentration en acide hypochloreux HClO supérieure à 7,0 mg
/ L l'échantillon contenant le réactif DPD est susceptible de se
décolorer et de conduire à un résultat faux".
M(HClO) =1+35,5+16=52,5 g / mol.
7,0 10-3 / 52,5 =1,3 10-4 mol / L soit 1,3
10-6 mol dans 10 mL.
1.4. Compléter le
tableau d’avancement par des valeurs numériques, pour un tube
test contenant 1,3.10-6 mol de chlore libre et une
pastille de DPD.
|
avancement
(mol)
|
chlore
libre
|
+DPD
|
-->
E
|
initial
|
0
|
1,3
10-6
|
3,0
10-5 |
0
|
intermédiaire
|
x
|
1,3
10-6 -x
|
3,0
10-5 -x
|
x
|
final
|
xmax
= 1,3 10-6
|
0
|
2,87
10-5
|
1,3
10-6
|
1.5. Sachant que la
DPD doit toujours être introduite en excès par rapport au chlore libre
pour effectuer le test, justifier que l’utilisation d’une seule
pastille est suffisante.
D'après le tableau, le DPD est en excès en utilisant une seule pastille.
2. Domaine de validité
indiqué par le fabricant de produits pour traitement de l'eau de piscine.
Au laboratoire, on se propose de vérifier l’indication du fabricant : «
Au-delà de 7 mg.L-1 les résultats du test peuvent s’avérer
faux ».
A partir d’une solution de « chlore libre » de concentration en masse C1
= 20 mg.L-1, et de pastilles de DPD on prépare diverses
solutions Si dont on mesure l’absorbance A avec un
spectrophotomètre.
2.1. À partir de la
liste ci-dessous, choisir la verrerie nécessaire à la préparation de la
solution S7 ( 4 mg / L) à partir de la solution S1
(20 mg / L). Justifier.
Burette graduée de 25 mL ; Fioles jaugées : 50,0 mL et 100,0 mL ;
Bécher de 50 mL ; Pipette graduée de 10,0 mL ; Pipettes jaugées de 5,0
mL et 10,0 mL ; Éprouvette graduée.
Facteur de
dilution 20 / 4 = 5.
Prélever 10,0 mL de
solution mère à l'aide d'une pipette jaugée de 10,0 mL.
Verser dans une fiole jaugée de 10,0 x5 =50,0 mL.
Compléter jusqu'au trait de jauge à l'aide d'eau distillée.
Boucher et agiter pour rendre homogène.
À l’aide d’un logiciel tableur-grapheur, on obtient la représentation
de l’absorbance A en fonction de la concentration en masse en « chlore
libre » ci-après.
2.2. Cette
représentation est-elle en accord avec la recommandation du fabricant ?
Justifier votre réponse par un tracé
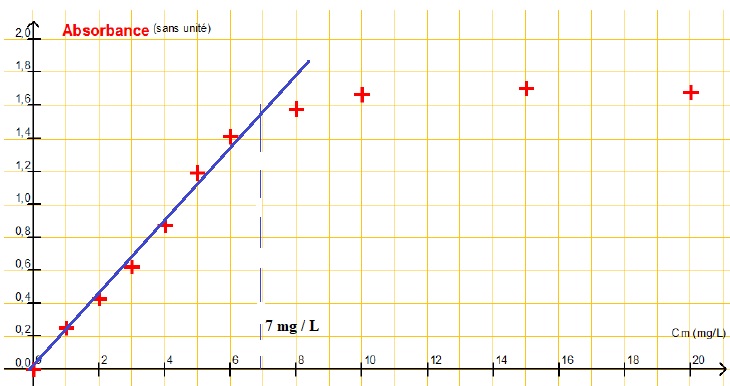
Au delà de 7 mg /L, l'absorbance et la concentration ne sont plus
proportionnelles. Donc accord avec l'affirmation du fabricant..
2.3. Donner le nom
de la loi mise en évidence en précisant son domaine de validité.
Loi de Beer-Lambert, valide pour des concentrations inférieures à 0,1
mol / L.
3. Détermination de la
concentration en « chlore libre » d’une eau de piscine.
Une eau de piscine est testée par un particulier à l’aide du
photomètre. Il obtient une valeur de 1,5 mg.L-1 de « chlore
libre ». Au laboratoire, pour la même eau, la mesure de l’absorbance
effectuée en suivant la procédure d’analyse décrite ci-dessus donne une
valeur A = 0,30.
3.1.Comparer les
valeurs des concentrations en masse en « chlore libre » obtenues par
les deux méthodes. La concentration en masse en « chlore libre »
est-elle suffisante pour assurer une stérilisation efficace de la
piscine ? Justifier.
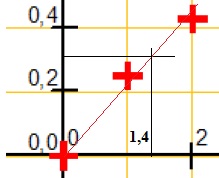
La seconde méthode conduit à 1,4 mg / L.
Ecart relatif : (1,5-1,4) / 1,5 ~0,067 ( ~ 7 %).
Pour un traitement et une désinfection efficace par chloration d’une
eau de piscine, la concentration en masse du « chlore libre » doit être
comprise
entre 2 et 4 mg / L. Ce n'est donc pas suffisant..
3.2.Sachant que la
piscine mesure 8,0 m de longueur sur 4,0 m de largeur et que sa
profondeur varie en pente régulière de 1,5 m à 2,5 m, déterminer le
nombre de galets de 20 g de chlore libre conviendrait-il de rajouter.
Volume : section trapèzoïdale x hauteur = [(1,5 +2,5) x8 /2] x4=64 m3
= 6,4 104 L.
Masse minimale de "chlore libre" : 6,4 104 x2 10-3=128
g.
Masse initiale de "chlore libre" : 1,5 10-3 x 6,4 104
=96 g.
Différence : 128-96 =32 g.
Il faut utiliser au minimum 2 sachets de 20 g.
|
Une
éolienne à la maison.
1. Produire de l’électricité.
L’éolienne se compose d'un rotor monté en haut d'un mât. La rotation
des pâles de l’éolienne permet la transformation de l’énergie du vent
en énergie électrique.
La puissance électrique ainsi produite dépend de la valeur de la vitesse du vent :
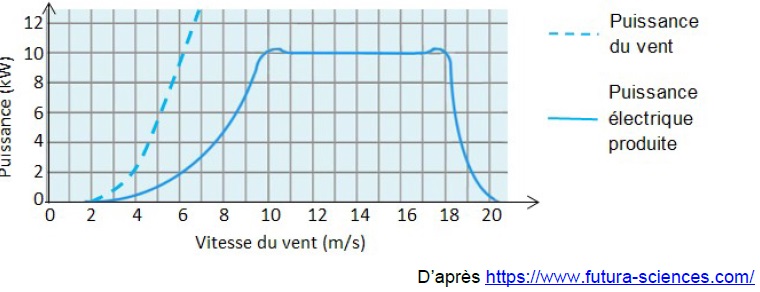
1.1.À quelle valeur minimale de la vitesse du vent, exprimée en km.h-1, l’éolienne commence-t-elle à produire de l’énergie électrique ?
A partir de 3 m /s soit 3 x 3,6 ~11 km / h.
1.2.Transfert d’énergie au sein de l’éolienne.
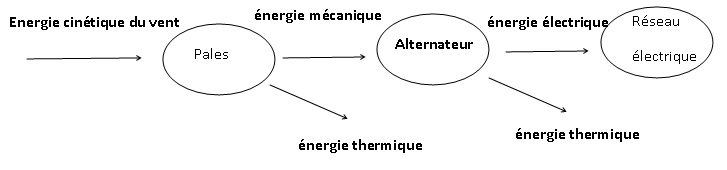
1.2.1. Représenter la chaîne énergétique de l’éolienne.
1.2.2.Définir le rendement de l’éolienne puis calculer sa valeur pour une valeur de vitesse du vent égale à 7 m.s-1.
Puissance électrique / puissance du vent = 3 / 13 ~0,23 ( 23 %).
1.3.L’éolienne est configurée pour produire une puissance maximale dans une plage de valeurs de vitesse du vent comprises entre 10 et 18 m.s-1. Interpréter la forme de la
courbe donnant la puissance électrique produite en fonction de la vitesse du vent pour des valeurs supérieures à 18 m.s-1.
La puissance électrique chute rapidement puis s'annule pour une vitesse du vent voisine de 20 m /s.
2. Stocker de l’électricité.
Les batteries sont des accumulateurs électrochimiques capables de convertir de l’énergie électrique en énergie chimique lors de leur charge et de l'énergie chimique en énergie
électrique lors de leur décharge. Parmi les dispositifs utilisés, les batteries au plomb sont actuellement les plus utilisées pour le stockage de l’énergie électrique produite par des
éoliennes domestiques.
Modèle électrique équivalent de la batterie en charge :
Lorsque la batterie est en charge sous la tension électrique U délivrée par l’éolienne, elle peut être modélisée par la portion de circuit électrique suivante :
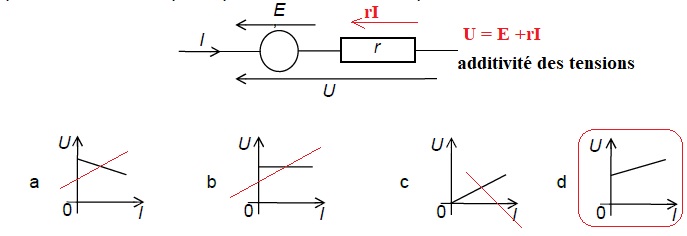
2.1. Relation entre l’intensité I et la tension U.
2.1.1. Justifier l’expression U = E' + rI (relation 1) liant la tension U aux bornes de la batterie en charge et l’intensité I du courant électrique de charge. Que représente r ?
2.1.2. Sélectionner le tracé correspondant à la charge de la batterie parmi les graphes ci-dessous. Justifier.
r représente la résistance interne de la batterie.
2.2.La relation 1 peut s’écrire : UI = EI + rI2 (relation 2).
2.2.1. Après avoir
donné la signification énergétique de chacun des termes de la relation
2, définir le rendement du transfert d’énergie au sein de la
batterie lors
de sa charge et montrer que h = E / U.
UI : puissance électrique reçue par la batterie en charge.
EI : puissance chimique stockée ; rI2 : puissance thermique dissipée.
Le rendement est égal à la puissance chimique stockée divisée par la puissance électrique reçue..
2.2.2.Vérifier que
la valeur du rendement est égale à 76 % pour une valeur de l’intensité
du courant électrique de charge égale à 10 A.
Tension à vide : E = 12,5 V. r = 0,4 ohm. U = E + rI = 12,5 +0,4 x10 = 16,5 V.
Rendement = 12,5 / 16,5 ~0,76. ( 76 %).
2.3.La masse de la batterie étudiée est de l’ordre de 15 kg. L’installation comporte 20 batteries identiques.
En tenant compte du rendement mentionné à la question 2.2.2,
l’éolienne, fonctionnant à sa puissance maximale, permet-elle de
fournir l’énergie électrique nécessaire à la
charge de ces batteries si celle-ci dure 1 h ?
Densité énergétique d'une batterie : 25 Wh / kg. Puissance maximale de l'éolienne : 10 kW.
Energie électrique fournie en une heure : 10 kWh.
Energie nécessaire à la charge complète des batteries : (25 x 15 x 20) / 0,76 =9868 Wh ~ 9,9 kWh.
L'énergie fournie est suffisante.
3. Consommer l’électricité.
La puissance électrique utilisable par le propriétaire de la maison lors de la décharge des batteries est de l’ordre de 6 kW.
Pour suivre sa consommation d’électricité, le propriétaire a réalisé un
programme en langage Python s’appuyant sur un classement des appareils
électriques par pack, c’est-à-dire par
groupe d’appareils de même puissance électrique.
pack
|
1
|
2
|
3
|
puissance électtrique ( kW)
|
2,5
|
1
|
0,1
|
appareils
|
chauffe-eau, machine à laver, radiateur, four
|
bouilloire électrique, grille-pain, fer à repasser
|
téléviseur, hotte aspirante, lampes basse consommation
|
3.1.La maison est aussi équipée d’un ordinateur. Associer cet appareil à son pack.
pack 3, faible consommation d'énergie électrique.
3.2. Programme en langage Python.
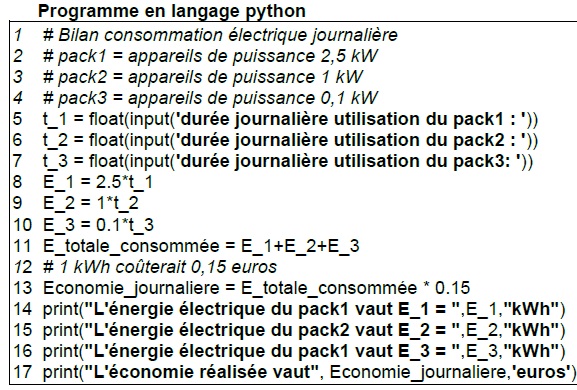
3.2.1. Expliquer la ligne 13.
Dépense totale liée à la consommation journalière d'électricité.
3.2.2. Lors d’une
journée, le four a été utilisé pendant 1h30, le chauffe-eau pendant 5h
et le radiateur pendant 2h. Le téléviseur est resté allumé 2h durant
une séance
de repassage. Quelle est le contenu de la dernière ligne affichée lors de l’exécution du programme ?
Consommation du four + chauffe-eau + radiateur : (5 +2 +1,5) x2,5 =21,25 kWh.
Consommation du fer : 2 kWh.
Consommation de la télé : 2x0,1 = 0,2 kWh.
Consommation totale :23,45 kWh.
Dépenses : 23,45 x0,15 ~3,52 €, valeur affichée par la dernière ligne du programme.
|
|
|












