Physique
chimie, engager la transition vers une mobilité plus propre, un
antiseptique, l'eau oxygénée,
séisme : comment localiser son épicentre.
E3C : enseignement de spécialité première générale.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
.
|
|
Engager
la transition vers une mobilité plus propre.
L’objectif de cet exercice est d’étudier deux solutions mises en oeuvre
aujourd’hui pour limiter l’impact écologique du transport routier.
1. L’évolution du parc
automobile français.
Le projet de « loi mobilités » fixe la fin des moteurs à combustion en
2040. Cet objectif sans précédent annonce de profonds changements pour
les constructeurs automobiles.
1.1. Définir une
réaction de combustion.
Les combustibles fossiles brûlent dans le dioxygène de l'air en donnant
du dioxyde de carbone et de l'eau. Il peut également se former des
oxydes d'azote. Cette réaction chimique est exothermique.
1.2. Expliquer
pourquoi les constructeurs automobiles sont encore aujourd’hui dans
l’obligation de développer des moyens pour limiter les polluants
rejetés par les véhicules fonctionnant à partir d’une réaction de
combustion.
Les vehicules utilisant l'essence ou le diesel représentent aujourd'hui
près de 93 % du parc automobiles. Les véhicules hybrides et électriques
ne représentent encore que 7 % de ce parc. La transition vers l'hybride
ou l'électrique est très lente. Les constructeurs doivent donc mettre
en oeuvre des moyens pour limiter les polluants rejetés par les
véhicules essence ou diesel.
2. Cas des moteurs
fonctionnant à l’essence : le bioéthanol.
Face à la hausse des coûts des produits pétroliers et pour limiter
l’impact écologique, l’usage de carburants obtenus à partir de végétaux
cultivés ou de résidus de cultures vivrières(1) se développe. Ces
carburants sont appelés « biocarburants » ou encore « agrocarburants ».
Pour les véhicules à essence, il est possible d’ajouter de l’éthanol («
bioéthanol ») à l’essence usuelle ; depuis l’année 2010, les véhicules
neufs peuvent rouler avec un carburant contenant jusqu’à 10 % d’éthanol
et nommé 95-E10.
(1) cultures vivrières : se dit des cultures dont les produits sont
destinés à l'alimentation humaine
2.1. Obtention du «
bioéthanol ».
Les végétaux contiennent des sucres (comme le saccharose). L’hydrolyse
du saccharose C12H22O11, réaction du
saccharose avec de l’eau, donne du glucose et du fructose, composés
chimiques de même formule brute C6H12O6.
Ensuite, la fermentation du glucose permet d’obtenir de l’éthanol et du
dioxyde de carbone.
2.1.1. Écrire
l’équation de la réaction modélisant l’hydrolyse du saccharose et celle
modélisant la fermentation du glucose.
Hydrolyse : C12H22O11
+ H2O --> 2 C6H12O6.
Fermentation du glucose : C6H12O6
-->2C2H6O + 2CO2.
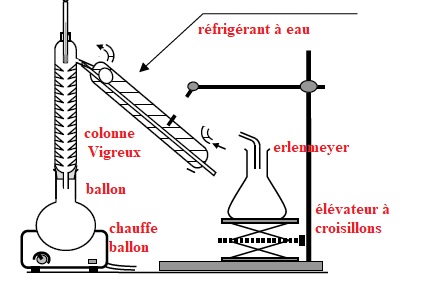
2.1.2. Pour extraire l’éthanol du
moût de fermentation, une distillation est nécessaire.
Parmi les deux montages proposés, identifier le montage à utiliser puis
annoter-le.
2.2. Énergie
molaire de la réaction de combustion de l’éthanol
La combustion de l’éthanol est modélisée par la réaction d’équation
suivante :
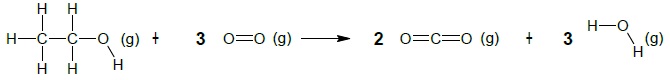
2.2.1. Compléter le
tableau en dénombrant les liaisons rompues et formées au cours de la
réaction de combustion de l’éthanol.
Liaisons
|
C-H
|
C-O
|
O-H
|
C-C
|
O=O
|
C=O
|
rompues
|
5
|
1
|
1
|
1
|
3
|
0
|
formées
|
0
|
0
|
6
|
0
|
0
|
4
|
2.2.2. Exprimer,
puis calculer l’énergie molaire de la réaction de combustion de
l’éthanol en fonction des énergies molaires de liaison. Interpréter le
signe de cette valeur.
E =5E(C-H) + E(C-O)+E(C-C) +3E(O=O) -5 E(OH) -4 E(C=O).
E = 5
x415 + 358 +346 +3 x 497- 5 x463 -4 x804 = 4270 - 2315-3216= -1261 kJ mol-1.
Cette réaction est exothermique.
2.2.3. Un litre
d’essence ne contenant pas de bioéthanol libère une énergie équivalente
à 35,5 MJ. Indiquer si l’ajout d’éthanol modifie le pouvoir calorifique
du carburant.
90 % d'esence : 0,9 x 35,5 = 31,95 MJ.
10 % d'éthanol ( 100 mL) de masse volumique 789 g / L soit 78,9 g.
n(éthanol) = 78,9 / M(éthanol) = 78,9 / 46 = 1,715 mol.
Energie libérée : 1,715 x 1,261 =2,16 MJ.
Total : 31,95 +2,16 = 34,1 MJ.
Ecart relatif entre les deux carburants : ( 35,5 -34,1) / 35,5
~0,04 (4 %). A 4 % près, le pouvoir calorifique du carburant
n'est pas modifié.
3. Cas des moteurs
fonctionnant au diesel : les technologies DOC et SCR
En 2014, la norme Euro 6 (norme européenne) est entrée en vigueur.
Sixième du nom, elle fixe d'une façon très précise le niveau de rejet
de quatre polluants présents dans les gaz d’échappement des véhicules
immatriculés dans les pays d'Europe de l'Ouest :
- NOx : les oxydes d’azote NO2 et NO ;
- HC : les hydrocarbures n’ayant pas été consommés dans la chambre de
combustion ;
- CO : le monoxyde de carbone ;
- PM : les particules fines.
Pour répondre aux dernières exigences européennes, les constructeurs
doivent équiper leurs véhicules de dispositifs pour traiter ces
polluants avant qu’ils ne s’échappent dans l’atmosphère.
Dans la suite du sujet, on s’intéressera à deux d’entre eux : le DOC
(Diesel Oxydation Catalyst) et le SCR (Selective Catalyst Reduction).
3.1. Le dispositif DOC
Les gaz d’échappement traversent une surface imprégnée de métaux
précieux favorisant leur réaction à haute température avec le dioxygène
de l’air. D’après le document constructeur décrivant le traitement des
gaz d’échappement, donner le polluant sur lequel le DOC est inactif.
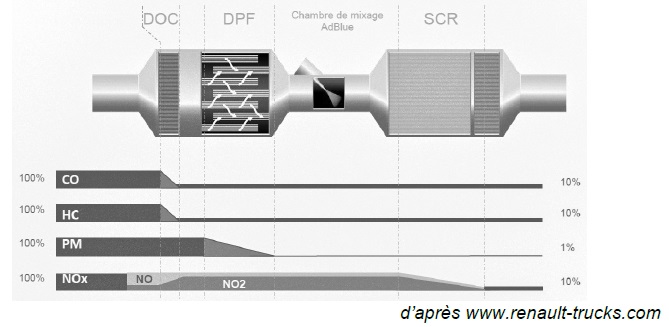
Le DOC est inactif pour les particules fines.
3.2. Le dispositif SCR
Le principe de ce dispositif repose sur l’usage d’un additif de type
Adblue®. L’additif est une solution incolore et biodégradable contenant
32,5 % d’urée, de formule brute CON2H4, et 67,5 %
d’eau.
Le schéma de Lewis de la molécule d’urée est représenté :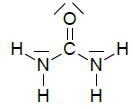
3.2.1. Dénombrer le
nombre d’électrons de valence des atomes de carbone, d’oxygène, d’azote
et d’hydrogène et justifier succinctement le schéma de Lewis de la
molécule d’urée.
Carbone : 4 électrons de valence engagés dans 4 liaisons.
H : 1 électron de valence engagé dans une liaison.
O : 6 électrons de valence, deux engagés dans deux liaisons et 2
doublets non liants.
N : 5 électrons de valence dont 3 engagés dans trois liaisons ( reste
un doublet non liant).
3.2.3. Choisir
parmi les formes géométriques suivantes -pyramidale, tétraédrique ou
triangulaire- celle formée par les trois atomes autour de l’atome de
carbone central. Justifier.
L'atome de carbone central est lié à 3 autres atomes ( type sp2).
De plus ce carbone ne possède aucun doublet non liant.
Les doublets liants se disposent le plus loin possible les uns des
autres.
Donc structure triangulaire.
|
|
Un
antiseptique, l'eau oxygénée.
Communément appelée « eau oxygénée », la solution aqueuse antiseptique
est utilisée, notamment pour détruire les virus, champignons et
bactéries. Son principe actif est le peroxyde d’hydrogène, de formule
brute H2O2.
Le but de cet exercice est de vérifier les indications figurant sur
l’étiquette d’une solution commerciale d’eau oxygénée.
1. Préparation de la
solution à titrer.
Afin de procéder au titrage du peroxyde d’hydrogène contenue dans la
solution commerciale par les ions permanganate, la solution commerciale
S est diluée dix fois pour obtenir la solution S’.
1.1. Rédiger
précisément le protocole à suivre pour réaliser cette dilution.
Prélever 10,0 mL de solution mère à l'aide d'une pipette jaugée.
Verser dans une fiole jaugée de 100,0 mL contenant un tiers d'eau
distillée.
Compléter jusqu'au trait de jauge à l'aide d'eau distillée.
Boucher, agiter pour rendre homogène.
1.2. Seuls les ions
permanganate sont colorés en solution aqueuse. Justifier cette
propriété et préciser la couleur de ces ions en solution aqueuse.
Spectre d’absorption obtenu au laboratoire d’une solution aqueuse de
permanganate de potassium :
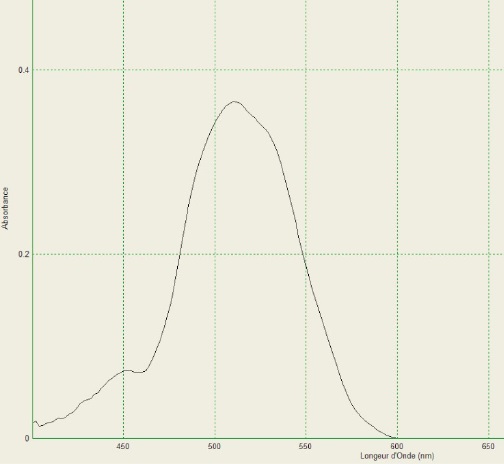
Le spectre d'absorption présente un maximum vers 530 nm ( rouge
orangé). La solution à la teinte complémentaire du rouge orangé, c'est
à dire le beu violet. .
2. Titrage du peroxyde
d’hydrogène par les ions permanganate.
Il est procédé au titrage d’oxydoréduction suivi par colorimétrie de
V’=20,0 ± 0,05 mL de la solution S’ par une solution de permanganate de
potassium de concentration en quantité de matière égale à C0
= (5,00 ± 0,2).10-2 mol.L-1. Lors de ce titrage
colorimétrique, le volume
obtenu à l’équivalence est de Véq = 13,7 ± 0,05 mL.
2.1. Schématiser le
montage expérimental utilisé en le légendant.
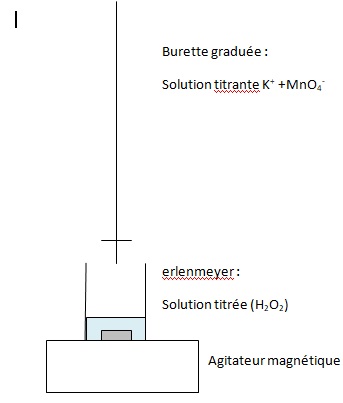
2.2. Écrire les
demi-équations électroniques mises en jeu lors du titrage permettant de
retrouver l’équation de la réaction d’oxydoréduction support du titrage.
2 fois { MnO4-aq
+ 8H+aq + 5e- --> Mn2+aq + 4H2O.
}
5
fois { H2O2
aq --> O2 +2H+aq + 2e-. }
2 MnO4-aq
+ 16H+aq + 10e- +5H2O2 aq--> 2Mn2+aq + 8H2O
+5O2 +10 H+aq + 10e-.
Simplifier : 2 MnO4-aq
+ 6H+aq +5H2O2
aq--> 2Mn2+aq +
8H2O +5O2
.
2.3. Définir l’équivalence et
donner, à l’équivalence, la relation entre les quantités de matière des
ions permanganate introduits n(MnO4-(aq)) et du
peroxyde d’hydrogène n(H2O2(aq)) initialement
présent dans l’échantillon titré.
A l'équivalence, les quantités de matière des réactifs sont en
proportions stoechiométriques.
n(H2O2(aq)) = 2,5 n(MnO4-(aq)) .
2.4. Comment l’équivalence est-elle
repérée lors de ce titrage ?
Avant
l'équivalence, l'eau oxygénée
est en excès, l'ion permanganate est en défaut ( solution incolore) ;
après l'équivalence, l'ion permanganate est en excès (teinte bleu
violet ).
2.5. Déterminer C’, la concentration
en quantité de matière du peroxyde d’hydrogène de la solution S’.
V' C' = 2,5 C0 Véq ; C' = 2,5 C0 Véq / V'
= 2,5 x 5,00 10-2
x 13,7 / 20,0 = 8,56 10-2 mol / L.
2.6. L’incertitude
relative sur C vaut U(C)=0,034 mol.L-1.Proposer un
encadrement de la concentration en quantité de matière C du peroxyde
d’hydrogène de la solution commerciale S.
C = 10 C' = 0,856 ±0,034 mol / L soit [ 0,822 ; 0,890 mol / L ].
3. Conformité de la
solution avec les indications de l’étiquette
3.1. Vérifier que
la concentration Cétiquette en quantité de matière du
peroxyde d’hydrogène indiquée sur l’étiquette correspond à 0,89 mol.L-1.
L'étiquette indique : eau oxygénée 10 volumes.
Le titre T d’une eau oxygénée exprime le volume de dioxygène que peut
libérer un litre d’eau oxygénée en volume.
T = 11,2 Cétiquette ; Cétiquette = 10 / 11,2 = 0,89 mol / L.
3.2. Les
indications de l’étiquette correspondent-elles à la solution
commerciale analysée ?
Oui, 0,89 appartient à l'intervalle [ 0,822 ; 0,890 mol / L ].
|
Séisme :
comment localiser son épicentre.
Les
séismes sont des événements redoutés par l’espèce humaine car ils sont
associés à des destructions massives et imprévisibles. Pourtant un
réseau de surveillance existe et détecte à
l’échelle planétaire les vibrations du sol dont la plupart sont inoffensives.
L’objectif de cet exercice est de comprendre comment on peut localiser l’épicentre d’un séisme.
Pour répondre à cette question, il faut d’abord s’intéresser aux ondes
de différentes natures responsables des secousses sismiques.
Nature des ondes sismiques.
Les ondes P sont aussi appelées ondes longitudinales. La vibration du
sol se fait par des dilatations et des compressions successives. Ces
perturbations se déplacent parallèlement à la
direction de propagation de l'onde. Les ondes P se propagent dans les milieux solides ainsi que dans les liquides.
Les ondes S sont aussi appelées ondes transversales. À leur passage,
les perturbations du sol s'effectuent perpendiculairement au sens de
propagation de l'onde. Les ondes S ne se
propagent que dans les milieux solides.
1. Les ondes P et S sont qualifiées d’ondes de type mécanique. Justifier cette affirmation.
Une onde mécanique est la propagation d'une perturbation dans un milieu
matériel avec transport d'énergie, sans transport de matière.
2. On considère ces
ondes comme périodiques. Indiquer quelle est la grandeur représentée
par la flèche double en pointillés sur la représentation précédente des
ondes S.
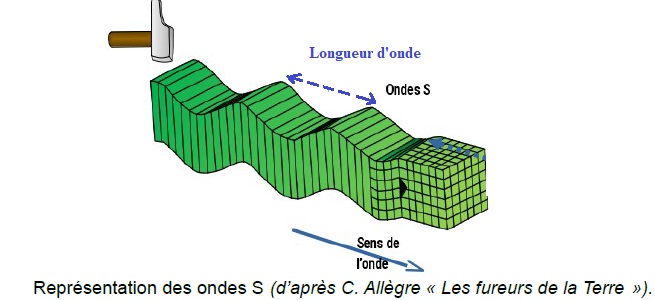
3. Indiquer quel est le type d’onde (P ou S) qui traverse le noyau terrestre. Justifier.
Le noyau terrestre étant liquide, seules les ondes P peuvent s'y propager.
Détection des séismes.
Lorsqu’un séisme se produit, les ondes sismiques ne sont pas forcément
détectées par l’être humain, mais elles peuvent être suivies par les
nombreux sismographes situés sur la Terre
dans des stations de surveillance sismique. Un sismographe traditionnel
est constitué d'un bâti fixe et d'un pendule qui réagit aux secousses.
Le dispositif permet de transcrire les secousses enregistrées sous
forme d'une courbe tracée si le mécanisme est mécanique, ou sous forme
de données informatiques pour les sismographes numériques modernes.
Ces sismographes permettent d’obtenir des sismogrammes qui peuvent être décomposés comme sur le document ci-dessous.
4. Déterminer si l’allure du sismogramme fourni est cohérente avec les informations du graphe précédent.
5. Représenter le retard de l’onde S par rapport à l’onde P.
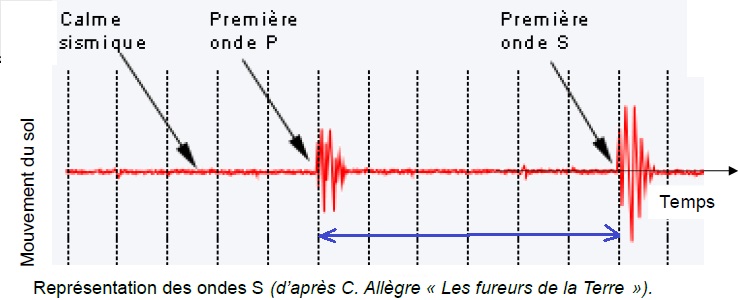
Dans un solide, la célérité des ondes P est comprises entre 8 et 13 km
/ s, celle des ondes S entre 5 à 7 km /s. Le sismogramme est cohérent,
les ondes P sont détectées en premier.
Localisation de l’épicentre.
Un séisme se produit généralement à l’intérieur du globe terrestre.
L’épicentre du séisme est le lieu de la surface, le plus proche de la
source du séisme. C’est le premier endroit de la surface
à recevoir les ondes sismiques.
Un séisme dont l’épicentre se situe en Équateur, pays d’Amérique du
Sud, s’est produit le 22 février 2019. L’enregistrement du sismographe
de la station de surveillance LFCV située au
Venezuela, un autre pays d’Amérique du Sud, a permis de mesurer les heures d’arrivée des ondes P et S.
On fera les hypothèses suivantes pour modéliser simplement la situation :
hypothèse 1 : les ondes P et S se propagent quasiment à la surface de la Terre ;
hypothèse 2 : le rayon de courbure de la Terre est négligeable ;
hypothèse 3 : les ondes se déplacent avec des célérités de valeurs constantes.
type d'onde
|
heure d'arrivée à la station LFCV
|
célérité moyenne des ondes ( km /s)
|
distance parcourue depuis l'épicentre
|
|
onde P
|
Hp = 10 h 21 min 01 s
|
Cp = 8,7 km / h
|
d
|
|
onde S
|
Hs = 10 h 24 min 03s
|
Cs = 4,7 km / s
|
d
|
|
6. On note d la distance entre l’épicentre du séisme et la station LFCV. En notant tS et tP respectivement les durées de propagation de l’onde S et de l’onde P entre l’épicentre et la
station LFCV, exprimer tS - tP en fonction de d, cS et cP.
d = Cs ts ; d = Cp tp ; ts -tp = d ( 1/ Cs - 1 / Cp).
7. Exprimer la distance d puis calculer sa valeur.
d = ( ts -tp) / (1/ Cs - 1 / Cp) = 182 ( 1 / 4,7 -1 / 8,7) =17,8 km.
En réalité, les calculs
de localisation d’épicentre prennent en compte le fait que les
célérités des ondes P et S ne sont pas constantes. On réalise pour cela
une hodochrone (voir ci-dessous) à
partir des enregistrements obtenus par plusieurs sismographes situés en
divers endroits du globe. Elle représente l’évolution du temps de
propagation des ondes sismiques P et S en
fonction de la distance à l’épicentre.
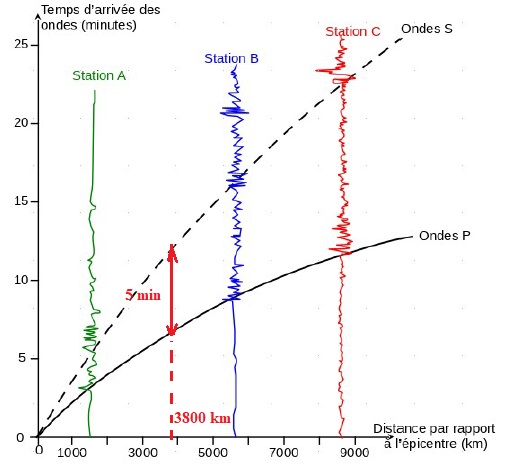
8. En exploitant
l’hodochrone, déterminer la distance L entre l’épicentre et une station
de mesure dans le cas où l’onde S arrive avec 5 min de retard par
rapport à l’onde P.
Environ 3800 km.
L’utilisation de l’hodochrone donne pour trois stations différentes les résultats suivants :
station
|
durée ts-tp (s)
|
distance L de la station à l'épicentre
|
LFCV( Venezuela)
|
183 s
|
1,93 103 km
|
HPAP ( Haïti)
|
231
|
2,39 103 km
|
GCAPE ( Guadeloupe)
|
247 s
|
2,78 103 km
|
On considère que, pour
chaque station, l’épicentre se trouve sur un cercle de rayon L. Pour
déterminer graphiquement la position de l’épicentre, on a utilisé un
programme informatique en langage Python. Ce programme permet de créer
un fond de carte, de positionner les trois stations LFCV, HPAP et
GCAPE, de tracer des cercles dont les centres sont les stations.
9. Indiquer pourquoi deux cercles dessinés sur la carte ne permet pas de positionner précisément l’épicentre du séisme.
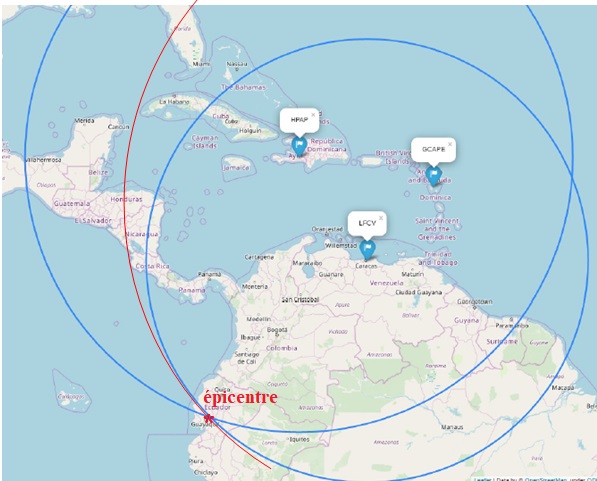
Les cercles bleus se coupent en deux endroits : deux épicentres sont
donc possibles. L'épicentre doit se trouver à l'intersection de trois
cercles.
10. Indiquer
l’information chiffrée manquante dans ce programme informatique, pour
tracer le cercle autour de la station GCAPE. Préciser le numéro de la
ligne à corriger et réécrire
cette ligne entièrement sur votre copie.
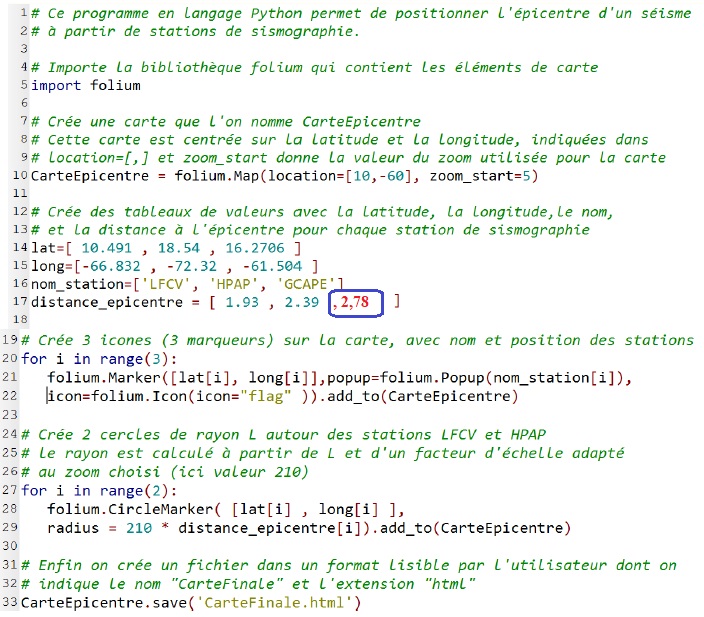
11. À la ligne 27, proposer une modification du programme permettant de faire apparaître le cercle autour de GCAPE.
27 for i in rang (3) :
12. Placer l’épicentre sur la carte en expliquant votre démarche.
Tracer un cercle de centre GCAPE, de rayon 7,3 cm proportionnel à 2,78 103 km.
5 cm correspond à 1,93 103 km
7,3 cm correpond à 2,78 103 km.
|
|
|










