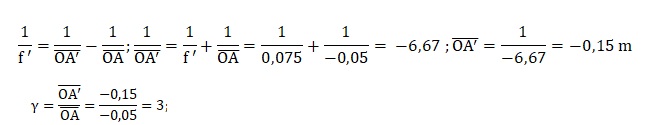Physique
chimie, le jet d'eau de Genève, l'otoscope,
le bleu de méthylène en médecine et en biologie.
E3C : enseignement de spécialité première générale.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
.
|
|
Le jet
d'eau de Genève.
Le but de cet exercice est de discuter de deux différentes
modélisations permettant d’étudier le mouvement du jet d’eau.
Données techniques :
- hauteur moyenne du jet : 140 m ;
- vitesse de sortie de l’eau : 200 km.h-1 ;
- débit : 500 L.s-1 ;
- puissance des pompes : 1000 kW ;
- intensité du champ de pesanteur terrestre : g = 9,81 m.s-2.
1. Estimation de la
hauteur du jet.
On souhaite estimer la hauteur du jet à l’aide d’un modèle très simple.
On s’intéresse à une goutte d’eau de masse m initialement au niveau du
sol, à qui on communique une vitesse v0 = 56 m.s-1,
soit 200 km.h-1, dirigée verticalement vers le haut.
Dans cette partie, on néglige les frottements de l’air sur la goutte.
La hauteur du jet est notée h1.
L’origine des altitudes pour le calcul de l’énergie potentielle de
pesanteur est choisie à la surface du lac, où est située la sortie des
pompes et l’axe Oz est orienté vers le haut.
1.1. Donner
l’expression de l’énergie mécanique de la goutte en fonction de sa
masse m, de sa vitesse v, de son altitude z et du champ de pesanteur
terrestre g.
Em = ½mv2 + mgz.
1.2. En déduire
l’expression de l’énergie mécanique en sortie des pompes en fonction de
v0 et m.
Em = ½mv02.
1.3. Indiquer en
justifiant la valeur de l’énergie cinétique de la goutte en haut du
jet. En déduire l’expression de l’énergie mécanique en haut du jet en
fonction de la hauteur h1 du jet, de g et de m.
En haut du jet, la vitesse est nulle et l'énergie mécanique est sous
forme potentielle : Em = m g h1.
1.4. Dans cette
partie, on considère que l’énergie mécanique de la goutte se conserve.
Estimer la hauteur h1 du jet. Commenter votre résultat.
m g h1 =
½mv02 ; h1 =v02 / (2g) = 562
/(2 x9,8) ~160 m.
Cette valeur ne correspond pas à la hauteur réelle ; ce modèle n'est
pas valide.
2. Un modèle plus complexe.
Une modélisation plus complexe permet d’obtenir les expressions de
l’altitude z et de la vitesse v de la goutte en fonction du temps. On
utilise le langage python afin d’obtenir le graphique des différentes
énergies en fonction du temps.
Dans cette partie, la hauteur du jet est notée h2.
Extrait du programme réalisé en python :
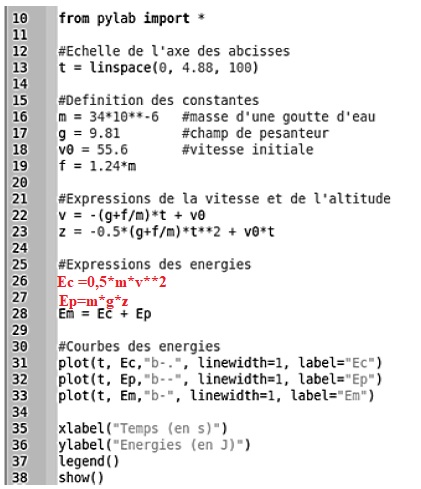
2.1. Compléter les
lignes 26 et 27 du programme en python afin qu’il permette d’obtenir la
représentation graphique de la figure 2.
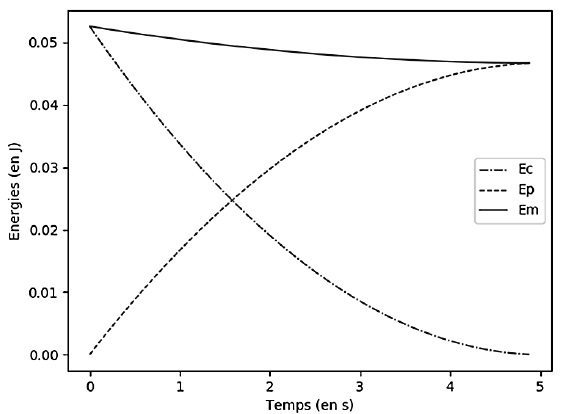
2.2. Commenter
l’évolution de l’énergie mécanique de la goutte obtenue sur le
graphique . Indiquer en quoi la modélisation choisie ici permet
d’obtenir des résultats plus en accord avec la réalité que le modèle
proposé dans la partie 1.
L'énergie mécanique diminue du travail des frottements.
Energie cinétique initiale : 0,053 = 0,5 m x562 ; m ~ 3,337
10-5 kg ;
énergie potentielle finale : mgh2 =0,047 ; h2 =
0,047 / (9,81 x 3,337 10-5) ~142 m.
Cette valeur est en accord avec la hauteur réelle.
2.3. La norme de la
force de frottement, supposée constante, qui s’applique sur la goutte
est notée f.
2.3.1.Relier la
variation d’énergie mécanique de la goutte entre sa position haute et
sa position basse ΔEm à la hauteur du jet h2 et à
la norme force de frottement f. En déduire l’expression de f.
ΔEm = -f h2 ;
f = - ΔEm / h2.
2.3.2.La valeur choisie dans le
programme pour f permet d’obtenir une valeur de 140 m pour la hauteur h2
du jet. À l’aide du graphique, évaluer ΔEm. En déduire la
valeur choisie pour la norme de la force de frottement.
ΔEm = -0,0060 J ; f = 0,0060 /
140 =4,3 10-5 N.
2.3.3.Les
équations de la mécanique des fluides permettent d’établir que la force
de frottement est proportionnelle au carré de la vitesse de la goutte.
Indiquer une éventuelle amélioration à apporter à la modélisation
utilisée dans la partie 2. Expliquer votre choix.
Ligne 19 : remplacer f = 1,24 m par f = k v02 avec k une
constante.
Lignes 22 à 24 : donner les nouvelles expressions de v, f = kv2, et z.
|
|
L'otoscope.
Cet outil médical permet d’observer le conduit auditif externe et le
tympan.
Partie 1 : étude de la
lentille de l’otoscope.
Après avoir démonté la lentille de l’otoscope, on souhaite déterminer
la valeur de sa distance focale.
1.1. Proposer une
méthode expérimentale simple permettant de vérifier expérimentalement
le caractère convergent de la lentille.
La lentille est mince sur les bords et bombée au entre.
Regarder à travers la lentille un objet situé à l'infini ( néon situé
au plafond ), son image se forme sur un écran ( la table par exemple) .
La distance lentille-écran est égale à la distance focale image.
Afin de déterminer la valeur de la distance focale de la lentille, on
procède à une série de mesures sur un banc d’optique. Pour cela, on
place la lentille de centre optique O à différentes distances OA d’un
objet lumineux AB perpendiculaire à l’axe optique (le point A de
l’objet lumineux, et le centre optique O de la lentille se trouvent sur
l’axe optique). Pour chaque valeur de la distance OA, on mesure la
valeur de la distance OA’ entre l’écran et le centre optique O de la
lentille lorsqu’on observe une image A’B’ nette sur l’écran placé
perpendiculairement à l’axe optique (le point A’ image du point A à
travers la lentille se trouve également sur l’axe optique). Les
résultats sont regroupés dans le tableau suivant.
1.2. Compléter le
tableau et placer le point correspondant sur le graphique.
mesure
algébrique OA' ( cm)
|
29,3
|
15,0
|
12,0
|
10,0
|
9,20
|
mesure
algébtique de OA (cm)
|
-10,0
|
-15,0
|
-20,0
|
-30,0
|
-40,0
|
1
/ mesure algébrique OA ( cm-1)
|
-1,00
10-1
|
-6,67
10-2
|
-5,00
10-2
|
-1 /30 =-3,33 10-2
|
-2,5
10-2
|
1
/ mesure algébrique OA' ( cm-1))
|
3,41
10-2
|
6,67
10-2 |
8,33
10-2 |
1 /10 = 0,100
|
1,09
10-1
|
1.3. Exploiter le
graphique pour déterminer la valeur de la distance focale de la
lentille.
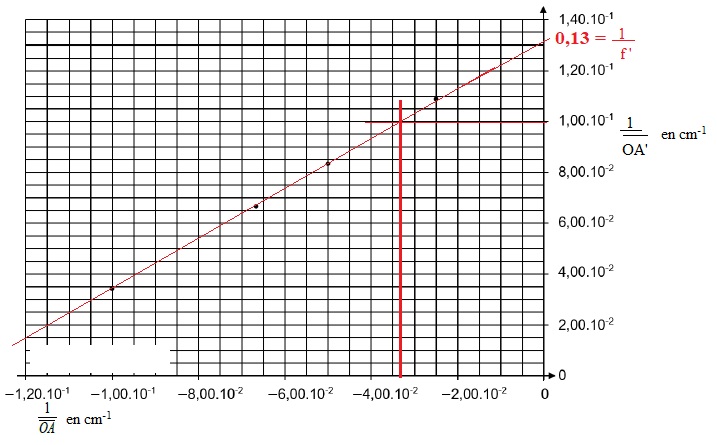
L'ordonné à l'origine est égale à 1 / f ' = 0,13 cm-1
; f ' = 1 /0,13 ~7,7 cm.
Un médecin utilise un modèle d’otoscope équipé d’une lentille
convergente de distance focale OF' = 7,5 cm pour observer le tympan
d’un patient adulte. Lorsque l’instrument est introduit dans le conduit
auditif du patient, la lentille de l’otoscope se trouve à une distance
OA = 5,0 cm du tympan. Ce dernier a une taille AB = 1,0 cm.
1.4. Compléter le
schéma à l’échelle modélisant la situation puis construire l’image A’B’
du tympan à travers la lentille de l’otoscope.
1.5. Déterminer
graphiquement les caractéristiques de l’image obtenue : position,
taille, sens et nature.
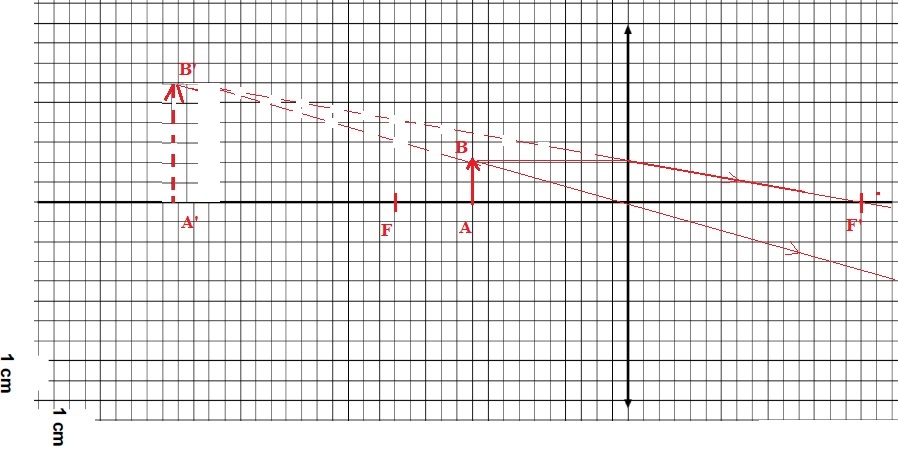
Image droite, virtuelle, trois fois plus grande que l'objet.
1.6. À partir de la
relation de conjugaison, retrouver la position de l’image construite.
1.7. Calculer le
grandissement de cette lentille et commenter le résultat par rapport
aux données de la brochure ( grandissement x 3).
Partie 2 : étude de la DEL de l’otoscope.
2.1.
Le médecin a équipé son otoscope de deux piles alcalines associées en
série de type AA-LR6 d’une capacité de 2850 mA.h chacune pour alimenter
la lampe de l’otoscope. Vérifier, en
détaillant le raisonnement suivi, si une autonomie d’une durée de 10 h,
valeur annoncée dans la brochure, est possible.
Capacité totale : 2 x2850 =5700 mA h ; intensité : I = 250 mA.
Autonomie : 5700 / 250 = 22,8 h.
L'autonomie est supérieure à 10 h.
2.2.
Lorsqu’on observe un tympan sans anomalie, il est perçu de couleur
grise. En cas d’otite, le tympan apparaît rouge. Indiquer la ou les
couleurs absorbées et diffusées par le tympan en
cas d’otite. Dans un souci de simplification, on supposera que la DEL
émet une lumière blanche.
Le tympan éclairé en lumière blanche apparaît rouge ; il diffuse le
rouge. Il absorbe la couleur complémentaire du rouge, c'est à dire le
cyan, mélange de bleu et de vert.
|
Le bleu
de méthylène en médecine et en biologie.
L’objectif
de cet exercice est d’étudier une propriété du bleu de méthylène puis
d’effectuer un contrôle de qualité, par dosage spectrophotométrique,
d’une préparation microscopique utilisée
dans le domaine de la santé.
Partie 1 : Propriétés oxydantes du bleu de méthylène
Un extrait de protocole est donné ci-dessous :
« Dans un erlenmeyer contenant une solution aqueuse de glucose, on ajoute une solution de bleu de méthylène BM+ (aq). Le mélange, initialement bleu, devient progressivement incolore ».
le glucose est noté RCHO(aq).
- la forme oxydée du bleu de méthylène, noté BM+, est la seule espèce colorée en solution aqueuse.
1.1. Donner la définition d’un oxydant.
Un oxydant est une espèce, ion, atome ou molécule, susceptible de gagner un ou plusieurs électrons.
1.2. Donner la définition d’une réduction.
Lors d' une réduction, un oxydant gagne un ou plusieurs électrons.
1.3. Écrire les demi-équations électroniques relatives aux couples du bleu de méthylène BM+ (aq) / BMH(aq) et du glucose RCOOH(aq) / RCHO(aq)
1.4. En déduire l’équation de la réaction modélisant la transformation décrite dans l’extrait du protocole.
Oxydation du glucose : RCHO aq +H2O --> RCOOH aq +2H+ aq+2e-.
Réduction de BM+ aq : BM+aq +2e- +H+aq-->BMH aq.
Ajouter : RCHO aq +H2O +BM+aq +2e- +H+aq --> RCOOH aq +2H+ aq+2e-+BMH aq.
Simplifier : RCHO aq +H2O +BM+aq --> RCOOH aq +H+ aq+BMH aq.
Partie 2 : Dosage d’une solution de bleu de méthylène.
Le bleu de méthylène est un colorant pour préparation microscopique
utilisé essentiellement pour colorer les noyaux des cellules afin
d’apprécier le nombre de cellules mortes.
Un technicien de laboratoire souhaite déterminer avec précision la
concentration du colorant dans une solution S dont l'étiquette porte
l'indication suivante :
« Bleu de méthylène 3,2 mmol.L-1 »
On note CS la concentration en bleu de méthylène de la solution S. Cette concentration est déterminée par une méthode spectrophotométrie.
On mesure l’évolution de l'absorbance A d'une solution de bleu de méthylène pour différentes longueurs d'onde λ.
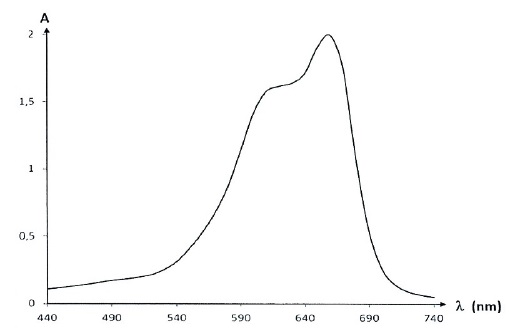
2.1. Commenter l’allure spectre d’absorption du bleu de méthylène et justifier la couleur de la solution de ce colorant.
Ce spectre présente un maximum d'absorption vers 650 nm ( couleur rouge
orangée). La solution de ce colorant est bleue, teinte complémentaire
du rouge orangé.
Pour déterminer la concentration CS en bleu de méthylène de la solution S, on prépare une gamme de solutions notées S1 à S4, de volume 25,0 mL chacune, à partir d’une solution mère
de concentration en masse égale à 5,0 mg.L-1.
L’absorbance des solutions a été mesurée à l’aide d’un spectrophotomètre préalablement réglé sur la valeur λmax du spectre d’absorption. Les résultats sont reproduits dans le tableau cidessous
solution
|
S0
|
S1
|
S2
|
S3
|
S4
|
concentration C en mg / L
|
5,0
|
4,0
|
3,0
|
2,0
|
1,0
|
absorbance A
|
0,610
|
0,480
|
0,374
|
0,243
|
0,126
|
A / C en L /mg
|
0,122
|
0,12
|
0,125
|
0,122
|
0,126
|
2.2. Ecrire le protocole détaillé de la préparation de la solution S3 à partir de la solution mère S0, en précisant la verrerie nécessaire.
Facteur de dilution 5,0 / 2,0 = 2,5.
Prélever 25,0 / 2,5 = 10,0 mL de solution mère à l'aide d'une pipette jaugée.
Verser dans une fiole jaugée de 25,0 mL.
Compléter avec de l'eau distillée jusqu'au trait de jauge.
Boucher, agiter pour rendre homogène.
2.3. La loi de Beer Lambert est-elle vérifiée ? Justifier le par le calcul, sans réaliser de graphique.
Valeur moyenne du rapport A / C =0,123.
A = 0,123 C, la loi de Beer Lambert est vérifiée.
2.4. En déduire une
relation entre A l’absorbance de la solution et C la concentration en
masse du bleu de méthylène, en précisant les unités des grandeurs.
A = 0,123 C ; A : absorbance sans unité et C concentration massique en mg / L.
2.5. Une solution SD de bleu de méthylène a été obtenue en diluant 400 fois la solution S. La mesure de l’absorbance de la solution SD vaut AD = 0,328.
2.5.1. Déterminer la concentration CD de la solution SD.
CD = AD / 0,123 = 0,328 / 0,123 = 2,67 mg / L.
2.5.2. En considérant une incertitude-type de mesure u(CS) égale à 0,2 mmol.L-1, la valeur CS obtenue expérimentalement est-elle en accord avec l’étiquetage de la solution S ? Justifier.
CS = 400 CD =400 x2,67 =1066,7 mg/ L ~1,07 g / L
M(bleu de méthylène) =M(C16H18N3SCl) = 16 x12 +18 +3 x14 +32 +35,5 =319,5 g / mol.
Concentration molaire : 1,07 / 319,5 =3,34 10-3 mol / L =3,34 mmol / L
CS ~(3,3 ±0,2) mmol / L, ( comprise entre 3,1 et 3,5 mmol / L).
Donc accord avec l'étiquetage.
|
|
|