Physique
chimie, synthèse et propriété lavante d'un savon, la pollution par le
dioxyde de soufre,
hypochlorite et eau de Javel.
E3C : enseignement de spécialité première générale.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
.
|
|
Synthèse
et propriété lavante d'un savon.
Protocole de la
synthèse d’un savon : l’oléate de sodium
Étape 1 : verser dans un ballon :
- 13,6 g d’huile d’olive (on considère que l’huile d’olive est de
l’oléine pure) ;
- 20 mL d’éthanol ;
- 20,0 mL de soude à 10 mol∙L-1 (en excès) ;
- quelques grains de pierre ponce.
Étape 2 : chauffer à reflux le mélange réactionnel pendant 20 minutes
environ.
Étape 3 : laisser refroidir le mélange quelques minutes puis le verser
dans un bécher contenant 200 mL d’une solution aqueuse concentrée de
chlorure de sodium.
Étape 4 : le précipité obtenu, l’oléate de sodium, est le savon. Il est
filtré, rincé à l’eau salée, séché, puis pesé.
Équation de la réaction modélisant la synthèse de l’oléate de sodium.
R est un groupe qui contient 17 atomes de carbone reliés entre eux.
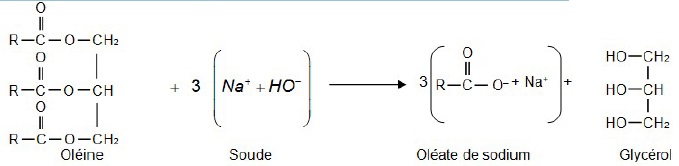
1. Espèces chimiques mises
en jeu dans la synthèse du savon.
1.1 L'eau
1.1.1 Établir le
schéma de Lewis de la molécule d'eau en déterminant au préalable le
nombre total d’électrons de valence.
L'oxygène compte 6 électrons de valence ; l'hydrogène compte un
électron de valence.
1.1.2
Interpréter la géométrie coudée de cette molécule.
Schéma de Lewis de la
molécule d'eau : 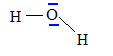
géométrie de la molécule d'eau : modèle VSEPR
type AX2E2 : 2 paires liantes et deux doublets
non liants autour de l'oxygène, atome central.
Ces 4 paires se disposent autour de l'atome central, de telle manière
que les répulsions soient minimales.La
molécule d'eau à la forme d'un V : l'angle est inférieur à 109 ° 28 ,
la répulsion entre les doublets non liants étant plus importante que la
répulsion entre les doublets liants.
1.1.3 En
déduire le caractère polaire ou apolaire de la molécule d'eau en
justifiant votre réponse.
L'atome d'oxygène porte deux paires d'électrons non liantes. l'atome
d'oxygène est plus électronégatif que l'atome d'hydrogène. La molécule
d'eau est polaire.
1.1.4 Justifier
que l’huile ne soit pas soluble dans l’eau.
L'huile porte de longues chaînes carbonées apolaires. De ce fait
l'huile n'est pas soluble dans l'eau.
1.2 La soude.
.La soude est une solution aqueuse d'hydroxyde de sodium. Elle est
obtenue dans le cas de cette synthèse par dissolution dans l'eau d'un
échantillon d'hydroxyde de sodium NaOH solidede masse m = 400 g pour
obtenir un volume V = 1,0 L de solution.
1.2.1 Exprimer,
puis calculer la concentration en quantité de matière en soluté apporté
de lasolution de soude.
n = m / M(NaOH) = 400 / 40 = 10 mol dans 1 L.
1.2.2 Écrire
l'équation de la réaction qui modélise la dissolution de l'hydroxyde de
sodium solide NaOH(s) dans l'eau.
NaOH(s) --> Na+aq + HO-aq.
1.2.3 Exprimer puis
calculer les concentrations en quantités de matière effectives des ions
présents dans la solution de soude.
[Na+aq] =[HO-aq] = C = 10 mol / L.
2. Analyse du protocole de synthèse
du savon
2.1. Étude
qualitative à partir des données fournies
2.1.1 Préciser le
rôle de l’éthanol dans l’étape 1 en justifiant votre réponse.
L'éthanol joue le rôle de solvant. L'eau et l'éthanol sont miscibles ;
l'huile est soluble dans l'éthanol.
2.1.2 Après le
chauffage, on réalise les deux étapes suivantes décrites sur la figure
3 cidessous
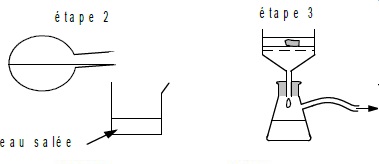
Justifier l’utilisation d’eau salée dans l’étape 3 et indiquer le nom
du dispositif utilisé à l’étape 4 et son intérêt.
Le savon est insoluble dans l'eau salée. Il précipite.
Filtration sur
Büchner : par rapport à une filtration simple, filtration plus
efficace et le solide récupéré est plus sec.
2.2 Étude quantitative
On cherche à déterminer le rendement de la synthèse du savon. La masse
du savon obtenu est égale à mexp = 10,5 g.
2.2.1 Vérifier que
la soude est le réactif introduit en excès.
n(soude) =20,0 x 10 = 200 mmol = 0,200 mol.
n(huile) = 13,6 /M(huile) = 13,6 / 884=0,0154 mol.
0,0154 mol d'oléïne réagissent avec 3 x0,0154 ~0,046 mol de soude.
Celle-ci est donc en escès.
2.2.2 Déterminer le
rendement de cette synthèse. Commenter.
Quantité de matière théorique de savon : 3 x0,0154 = 0,0462 mol.
Masse théorique de savon : 0,0462 M(savon) =0,0462 x 304 ~14,0 g.
Rendement : masse réelle / masse théorique = 10,5 / 14,0 =0,75.
Ce rendement est assez élévé.
3. Propriétés
lavantes d'un savon
On s’intéresse désormais aux propriétés lavantes d’un savon.
On peut représenter schématiquement l’ion oléate, l’ion actif du savon
de la façon suivante :
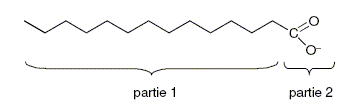
3.1 Caractériser les parties 1 et 2
des schémas de l’ion à l'aide du vocabulaire suivant : hydrophile,
hydrophobe, lipophile, lipophobe.
La longue chaine carbonnée ( partie 1) est hydrophobe et lipophile ; la
partie 2 est hydrophile et lipophobe.
3.2 En déduire,
parmi les schémas suivants, celui qui peut expliquer le mode d'action
d'un savon. Décrire en un schéma et/ou une ou deux phrases l’étape
suivante menant à l’élimination de la tache de graisse lors du lavage
par du savon.

La
partie lipophile ( hydrophobe) se fixe sur la graisse ; la partie
hydrophile reste dans l'eau.
En frottant, la tache de graisse se détache du tissu et se trouve
entraînée dans l'eau.
|
|
Pollution par le dioxyde de soufre.
L’objectif
de l’exercice est de comparer la teneur en soufre d’un fioul domestique
datant de 1960 et d’un fioul domestique « nouvelle génération ».
La méthode européenne de référence utilisée pour la mesure de la
quantité de matière de dioxyde de soufre gazeux est la fluorescence
ultraviolette.
On se propose de déterminer la quantité de matière de dioxyde de soufre
produite lors de la combustion des deux fiouls par une méthode pouvant
être mise en oeuvre dans un laboratoire de lycée, un titrage ayant pour
support une réaction d’oxydo-réduction.
Données
- Couples oxydant-réducteur mis en jeu :
MnO4-aq / Mn2+aq et SO42-aq / SO2 aq.
- Dans le titrage, parmi les espèces présentes, seuls les ions permanganate MnO4-aq confèrent à la solution aqueuse une couleur violette.
Soit S1 une solution aqueuse contenant une quantité de
matière de dioxyde de soufre identique à celle utilisée pour la mesure,
par la méthode européenne de référence, à la fin de la combustion
totale du fioul « nouvelle génération ».
On réalise le titrage d’un volume V1= 20,00 ± 0,02 mL de solution S1
introduite dans un bécher par une solution aqueuse de permanganate de
potassium acidifiée dont la concentration en quantité de matière est C2 = (7,50 ± 0,01) x 10-3mol.L-1.
Lors du titrage, l’équivalence est obtenue pour un volume versé VE = 8,5 ± 0,4 mL de la solution aqueuse de permanganate de potassium.
1. Une des
impuretés soufrées dans le fioul, évoqué dans l’introduction, est le
soufre. Écrire l’équation de la réaction modélisant la combustion du
soufre S(s).
S(s) + O2(g) --> SO2(g).
2. Réaliser et légender précisément le schéma du montage utilisé pour réaliser le titrage.
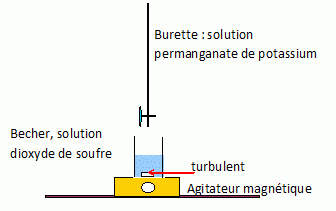
3. Établir, à l’aide des données l’équation de la réaction d’oxydo-réduction support du titrage écrite ci-après:
2 fois {
MnO4- + 8H+ +
5e- = Mn2+ + 4H2O
} l'oxydant
MnO4-se réduit.
5 fois { SO2
+2H2O = SO42- +
4H+ +2e-
} le réducteur SO2 s'oxyde.
dans le bilan pas d'électrons :
2 MnO4- + 5SO2
+2H2O = 2 Mn2+ +5
SO42- + 4H+.
4. Définir l’équivalence d’un titrage.
A l'équivalence, les quantités de matière des réactifs sont en
proportions stoechiométriques. Avant l'équivalence, l'ion permanganate
est en défaut, après l'équivalence il est en excès.
5. Décrire
qualitativement comment évoluent, au cours du titrage, les quantités de
matière des espèces chimiques présentes dans le bécher.
La quantité de matière de SO2 aq diminue ; celles de SO42- et Mn2+aq croissent.
6. Indiquer comment s’effectue le repérage de l’équivalence, en précisant votre raisonnement.
Avant
l'équivalence, l'ion permanganate est en défaut ( solution incolore ),
après l'équivalence il est en excès ( teinte violette ).
7. On note n1, la quantité de matière initiale de dioxyde de soufre et n2,
la quantité de matière des ions permanganate versés pour atteindre
l’équivalence. Donner la relation entre les quantités de matière de
réactifs introduits à l’équivalence.
2n1 = 5 n2 ; n1 = 2,5 x C2 VE.
8. L’incertitude-type sur la quantité de matière de dioxyde de soufre étant évaluée à une valeur de 8x10-6
mol lors de ce titrage, donner un encadrement à la valeur de la
quantité de matière initiale de dioxyde de soufre dans la solution S1.
n1 = 2,5 x 8,5 10-3 x 7,50 10-3 =1,59 10-4 ± 8 10-6 mol. [ 1,51 10-4 ; 1,67 10-4 mol / L].
9. La quantité de matière de dioxyde de soufre dans le fioul datant de 1960 est déterminée égale à 2,5 x 10-2
mol, ce qui correspond à une teneur en soufre de 0,8 %. Estimer la
teneur en soufre du fioul « nouvelle génération ». Commenter.
1,59 10-4 /(2,5 10-2) x 0,8 =5,1 10-3 %.
Le fioul nouvelle génération contient 0,8 /(5,1 10-3) =157 fois moins de soufre que le fuel des années 60.
10. Il est possible
d’acheter du fioul domestique, notamment sur internet. Certains sites
utilisent le terme de « fioul désoufré ». Justifier cette appellation.
Le fuel nouvelle génération contient très peu de soufre.
11. La fermeture
des centrales thermiques produisant de l’électricité permettra-t-il
d’atteindre les objectifs écologiques qui sont de réduire de façon
significative les émissions de gaz à effet de serre d’ici 2050 et
autres polluants gazeux ? Justifier et proposer une alternative pour
produire de l’électricité.
La production d'électricité via les centrales thermiques à combustibles fossiles représentent près de 40 % des émmissions de CO2. La fermeture de ces centrales permettra de se rapprocher des objectifs écologiques.
Alternative : photovoltaïque, éolien, hydraulique..
|
Hypochlorite et eau de Javel.
L’eau de Javel est une solution aqueuse contenant des ions hypochlorite CℓO−(aq).
Le but de cet exercice est d’expliciter certaines des indications
données par un fabricant proposant deux types de conditionnement,
flacon et berlingot, et d’étudier une méthode de dosage de l’eau de
Javel.
Flacon de 2L, concentration 9 °chl ; berlingot de 250 mL, concentration 36°chl.
1. Degré chlorométrique d’une eau de Javel.
Industriellement, l’eau de Javel est obtenue par barbotage de dichlore gazeux Cℓ2(g) dans une solution aqueuse d’hydroxyde de sodium (Na+(aq) + HO−(aq)).
La transformation chimique ayant lieu peut être considérée comme totale
et elle est modélisée par la réaction d’équation :
Cℓ2(g) + 2 HO−(aq) --> Cℓ−(aq) + CℓO−(aq) + H2O(ℓ)
En France, l’eau de Javel est souvent caractérisée par son degré
chlorométrique (° chl) qui correspond au volume, exprimé en litres, de
dichlore gazeux nécessaire pour préparer un litre de solution d’eau de
Javel. Ce volume est mesuré dans des conditions de température et de
pression telles que le volume molaire des gaz est Vm = 22,4 L.mol−1.
1.1. Montrer que la concentration en quantité de matière des ions hypochlorite CℓO−(aq) d’une eau de Javel de titre chlorométrique 9° chl est de 0,4 mol.L−1.
9 L de dichlore ont été nécessaires pour préparer la solution soit 9 / 22,4 = 0,4 mol par litre de Javel.
Par suite (ClO-aq] = 0,4 mol / L.
1.2. Justifier le
protocole de dilution indiqué sur l’étiquette d’un berlingot de « JAVEL
CONCENTRÉE » pour obtenir une eau de Javel prête à l’emploi.
Verser le contenu d'un berlingot dans une bouteille de 1 L est compléter avec de l'eau froide.
On dilue 4 fois la javel de ce berlingot : la solution diluée, prète à l'emploi est donc à 9 ° chl.
2. Limite de conservation des eaux de Javel.
L’ion hypochlorite CℓO−(aq) en solution aqueuse est
fortement oxydant et capable d’oxyder l’eau elle-même. On peut
modéliser cette transformation à partir des deux couples oxydant
-réducteur suivants : CℓO−(aq) / Cℓ−(aq) et O2(g) / H2O(ℓ).
Cette transformation, plus ou moins lente en fonction de certains
paramètres, impose une limite de durée d’utilisation aux eaux de Javel.
2.1. Établir
l’équation de la réaction d’oxydo-réduction modélisant l’oxydation de
l’eau par les ions hypochlorite. Justifier le rôle oxydant de l’ion
hypochlorite.
L' ion ClO-aq, l'oxydant, se réduit en gagnant des électrons : ClO-aq + 2H+aq+2e- --> Cl-aq +H2O .
Le réducteur, l'eau ,s'oxyde en libérant des électrons : H2O --> ½O2+ 2H+ +2e-.
On ajoute ces deux demi-équations : ClO-aq + 2H+aq+2e- +H2O --> Cl-aq +H2O + ½O2+ 2H+ aq+2e-.
Simplifier : ClO-aq --> Cl-aq + ½O2 .
2.2. Indiquer comment évolue le degré chlorométrique d’une eau de Javel dans le temps. Justifier la réponse.
Au cours du temps, la concentration en ion hypochlorite diminue ; il en est de même de son degré chlorométrique.
2.3. D’après les
indications fournies par le fabricant, identifier trois facteurs qui
influent sur la dégradation de l’eau de Javel.
La durée, la chaleur et la lumière.
3. Titrage d’une eau de Javel prête à l’emploi.
On se propose de contrôler expérimentalement la concentration en ions hypochlorite CℓO−(aq) présents dans une solution S d’eau de JAVEL achetée en flacon de 2 L.
Pour cela, on procède au titrage de la solution S par une méthode indirecte dont les étapes sont décrites ci-après.
Étape 1 :
La solution S étant trop concentrée pour être dosée directement, on
effectue une dilution au dixième afin d’obtenir un volume de 50,0 mL de
solution diluée notée S’.
Étape 2 :
Dans un erlenmeyer de 150 mL, on introduit dans l’ordre :
• un volume V’ = 10,0 mL de solution S’ ;
• 20 mL d’une solution aqueuse d’iodure de potassium (K+(aq) + I−(aq)) de concentration effective en ions iodure [I−(aq)] = 0,10 mol.L−1 ;
• quelques gouttes d’acide sulfurique concentré.
La transformation chimique ayant lieu lors de cette étape peut être modélisée par la réaction d’équation :
CℓO−(aq) + 2 I−(aq) + 2 H+(aq) --> Cℓ−(aq) + I2(aq) + H2O(ℓ)
Les ions iodure I−(aq) étant apportés en excès dans le mélange, la totalité des ions hypochlorite CℓO−(aq) initialement présents sont consommés.
Étape 3 :
On réalise le titrage du diiode I2(aq) formé à l’issue de l’étape 2 par une solution aqueuse de thiosulfate de sodium (2 Na+(aq) + S2O32−(aq)) de concentration effective en ions thiosulfate [S2O32−(aq)] = 5,0 10−2 mol.L−1.
La réaction support du titrage a pour équation :
I2(aq) + 2 S2O32−(aq) --> 2 I−(aq) + S4O62−(aq).
À l’approche de l’équivalence, on ajoute quelques gouttes de thiodène dans le mélange réactionnel.
Lors de ce titrage, le volume de solution aqueuse de thiosulfate de sodium versé pour atteindre l’équivalence est VE = 12,4 mL.
En solution aqueuse, le diiode I2(aq) est de couleur brune à forte concentration et jaune très pâle à faible concentration.
Une solution aqueuse de diiode devient bleu foncé en présence de thiodène.
Parmi l’ensemble des espèces mentionnées dans cet exercice, seul le diiode est coloré en solution aqueuse.
3.1. Indiquer les précautions à prendre lors de la manipulation des solutions S et S’.
Port de gants, blouse et lunettes de protection.
3.2. On donne le
schéma du dispositif expérimental mis en oeuvre lors de l’étape 3.
Indiquer sans recopier le schéma sur la copie, les termes à mettre en
(a), (b), (c), (d) et (e) pour compléter la légende de ce schéma.
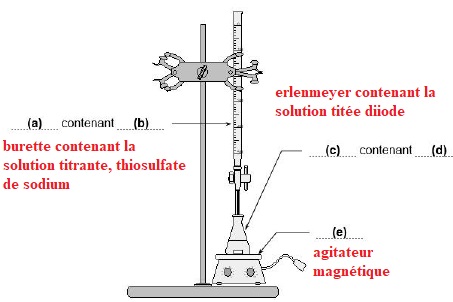
3.3. Indiquer comment l’équivalence est repérée lors de ce titrage. Justifier la réponse.
Avant l'équivalence le diiode est en excès : teinte violette en présence de thiodène.
Après l'équivalence, le diiode est en défaut : solution incolore.
3.4. Déduire du
résultat de ce titrage la quantité de matière de diiode formé dans le
mélange réactionnel à l’issue de l’étape 2 et titré par le thiosulfate.
A l'équivalence : n(diiode ) = 0,5 n(thiosulfate) = 0,5 x VE x[S2O32−(aq)] =0,5 x 12,4 x 5,0 10-2 = 0,31 mmol.
3.5. Déterminer la concentration en quantité de matière des ions hypochlorite de la solution S et commenter le résultat.
Quantité de matière :
- initiale d'ion iodure : 20 x0,10 = 2,0 mmol.
- de diiode formé à l'étape 2 : 0,31 mmol.
- d'ion hypochlorite : 0,31 mmol contenu dans 10 mL de solution S'.
- d'ion hypochlorite : 5 x0,31=1,55 mmol contenu dans 50 mL de solution S'.
Concentration en ion hypochlorite dans S' : C' = 1,55 / 50 = 0,031 mol/L.
Concentration en solution hypochlorite dans S : 0,031 x10= 0,31 mol/L.
Concentration initiale en ion hypochlorite : 0,4 mol / L.
La concentration en ion hypochlorite a diminué de (0,4 -0,31) / 0,4 ~0,23 ( 23 %).
|
|
|






